
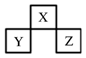
| A.原子半径的大小为:Z>Y>X |
| B.若Y的氧化物为两性氧化物,则X、Z分别形成单质的微观结构中均可能具有正四面体构型 |
| C.若X的氢化物与Z的最高价氧化物对应水化物能反应,则生成的盐仅有一种 |
| D.若Y与Z的核电荷数之和为X的4倍,则X、Z形成的对应氢化物的熔沸点前者高于后者 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.气态氢化物的稳定性:HF>NH3>PH3>H2S |
| B.沸点:苯酚>CH3OH>HCHO>CH3COOH |
| C.离子半径:S2->O2->F- |
| D.相同温度、相同浓度溶液中水的电离程度:NH4Cl>CH3COOH>HCl>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.全部可以 | B.仅②不可以 | C.仅②⑤不可以 | D.③④可以 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,说明该元素与氧元素的非金属性的强弱______________________
,说明该元素与氧元素的非金属性的强弱______________________ __。
__。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2与H2反应生成HCl,而S与H2反应生成H2S |
| B.Cl2与铁反应生成FeCl3,而S与铁反应生成FeS |
| C.Cl2能与水反应,而S不与水反应 |
| D.Cl原子最外层电子数为7,而S原子最外层电子数为6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 甲 | 乙 | | ||||||||
| 丙 | 丁 | 戊
查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 对Na、Mg、Al的有关性质的叙述正确的是:
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |