
| A、Na+、Ba2+、NO3-、Cl- |
| B、NO3-、Mg2+、Na+、SO42- |
| C、CO32-、K+、Cl-、Na+ |
| D、Fe2+、NO3-、SO42-、Na+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NaOH溶液与0.2 mol?L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.2 mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
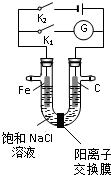
| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有食品添加剂的食物对人体健康均有害 |
| B、普通玻璃和氮化硅陶瓷都属于新型无机非金属材料 |
| C、大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 |
| D、为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质也相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、1735 Cl 与 1737 Cl 得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
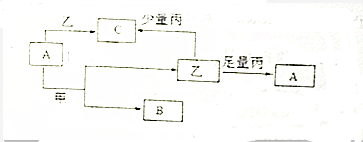
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com