
| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在Cu2O固体中加入足量的稀硫酸:Cu2O+2H+═Cu+Cu2++H2O |
分析 A.铁离子具有氧化性,能够氧化碘离子;
B.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
C.氢氧化钠少量,反应生成碳酸钙沉淀、碳酸氢钠和水;
D.氧化亚铜与稀硫酸反应生成铜、硫酸铜和水.
解答 解:A.Fe2O3溶于氢碘酸溶液中,二者发生氧化还原反应,正确的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故A错误;
B.Al片溶于NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B正确;
C.Ca(HCO3)2溶液与少量NaOH溶液,反应生成碳酸钙、碳酸氢钠和水,反应的离子方程式为:HCO3-+Ca2++OH-═CaCO3↓+H2O,故C正确;
D.在Cu2O固体中加入足量的稀硫酸,反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O,故D正确;
故选A.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中,反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为2Al3++3CO32-═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内NO2的生成速率为2.96×10-3 mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡其他条件不变,将容器的体积压缩到原来1/2,则c(N2O5)<5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
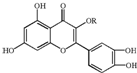 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物最多可与7mol Br2完全反应 | |
| D. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质不属电解质,就属于非电解质 | |
| B. | SO3溶于水可导电,SO3属于电解质 | |
| C. | 能导电的物质属于电解质,NaCl属于电解质,NaCl晶体可导电 | |
| D. | 已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com