
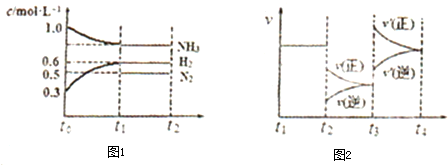
| A、若容器内气体的密度不再发生变化,则说明反应达到平衡状态 | B、若t1=20s,则从to-t1内的平均反应速率v(NH3)=0.01 mol?L-1 | C、图2中,t2时改变的条件是降低温度,t3时改变的条件是增大压强 | D、若t2时,再向容器中加入1.4 mol NH3、0.8 mol H2,则平衡将逆向移动 |
| △c |
| V |
| 0.2mol/L |
| 20s |
| 2 |
| 3 |
| 0.63×0.5 |
| 0.82 |
| 1.4 |
| 2 |
| 0.8 |
| 2 |
| 13×0.5 |
| 1.52 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省高三下学期第一次调研考试(理综)化学部分 题型:选择题
一定条件下,向2L恒容密闭容器中加入2molX、1
molY,发生如下反应:2X(g) + Y  3Z(g);△H = -a kJ/mol
(a>0)。经过60 s达平衡,此时Y的物质的量为0.2mol。
3Z(g);△H = -a kJ/mol
(a>0)。经过60 s达平衡,此时Y的物质的量为0.2mol。
下列说法中错误的是
A. 用Z表示的化学反应速率为1.2 mol·L—1·min—1
B. 若再充入1 mol Z,重新达平衡时,X的体积分数不变,则Y为气态
C. 达平衡后,实际放出的热量为b kJ,则b=a
D. 若使容器体积变为1L,Z的物质的量不会增大
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(十五)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com