
| 起始浓度(mol/L) | 甲 | 乙 | 丙 |
| C(H2) | 0.010 | 0.020 | 0.020 |
| C(CO2) | 0.010 | 0.010 | 0.020 |
| A. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 | |
| B. | 平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L | |
| D. | 改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0 |
分析 A、依据起始量分析判断,浓度越大反应速率越快;
B、丙相当于将两份甲压缩在一个容器中,相当于增大压强,但两边的计量数相等,平衡不移动;
C、丙相当于将两份甲压缩在一个容器中,相当于增大压强,而平衡不移动,所以平衡是丙中各组分中各组分的浓度是甲的2倍;
D、改变条件使乙中温度降低,新平衡中H2的浓度增大,说明平衡逆向移动,所以逆反应是放热反应.
解答 解:A、甲、乙、丙起始量比较丙的起始浓度大反应速率快达到平衡需要的时间少,甲的浓度最少反应速率最慢,所以反应开始时,丙中的反应速率最快,甲中的反应速率最慢,故A正确;
B、丙相当于将两份甲压缩在一个容器中,相当于增大压强,但两边的计量数相等,平衡不移动,所以丙、甲中CO2的转化率相等,乙相当于在甲的基础上增加氢气的浓度,平衡正向移动,二氧化碳的转化率增大,则乙>甲=丙=60%,故B正确;
C、丙相当于将两份甲压缩在一个容器中,相当于增大压强,而平衡不移动,所以平衡是丙中各组分中各组分的浓度是甲的2倍,而甲中平衡时二氧化碳的浓度为0.004mol/L,则丙中平衡时二氧化碳的浓度为0.008mol/L,故C错误;
D、改变条件使乙中温度降低,新平衡中H2的浓度增大,说明平衡逆向移动,所以逆反应是放热反应,则正反应的△H>0,故D正确;
故选C.
点评 本题考查了化学平衡的分析判断,平衡计算和反应物转化率计算分析应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铁粉溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 用 CuSO4溶液吸收 H2S:Cu2++H2S═CuS↓+2H+ | |
| D. | 向 NH4HSO4 溶液中滴加少量的 Ba(OH)2溶液:Ba2++2OH-+NH+H2O+H++SO2-═BaSO4↓+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2mol•L-1的 Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] | |
| B. | 浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a>b>c | |
| C. | NaHSO3溶液显酸性,c(Na+)>c(HSO3- )>c(H+)>c(OH-)>c(SO32-) | |
| D. | pH=3.6 的0.lmol/LHX 与0.lmol/LNaX 的混合溶液中,2c(H+)-2c(OH-)=c(X-)-c(HX) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.12 g | B. | 4.24 g | C. | 3.18 g | D. | 5.28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
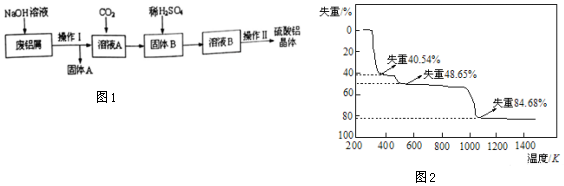
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| B. | 钠与硫酸铜溶液反应:Cu2++2Na═2Na++Cu | |
| C. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com