
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:





 结构.
结构.




查看答案和解析>>
科目:高中化学 来源: 题型:




 结构.
结构.

 +CH3COOH
+CH3COOH +CH3COOH
+CH3COOH 化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式:
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
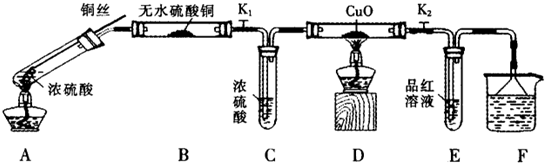
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com