
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
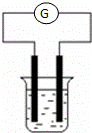
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:
| G 实验分组 | 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | … | … |
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是 .
(2)在①中,Cu片上观察到的现象是: ;
(3)在②中,溶液中H+向金属片 移动;
(4)在④中,两金属片上均无气泡放出.此时两金属片上的电极反应式分别为:Cu: ;B: ;
(5)如果实验⑤用B、D,则导线中电流方向为: (填B→D或D→B);
(6)已知反应:Cu+2Fe3+═Cu2++2Fe2+.请用下列试剂和材料,用上图所示装置,将此反应设计成原电池并检验正极产物.
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液
材料:Cu片、Fe片、石墨棒
a、设计电池应选用的试剂和材料是: ;
b、检验正极产物选用的试剂是 ,检验反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g)。若c(HI)由1.0 mol·L-1降低到0.7 mol·L-1时,需要15 s,那么c(HI)由0.7 mol·L-1降到0.5 mol·L-1时,所需反应的时间为( )
A.等于5 s B.等于10 s
C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数的数值,下列说法正确的是
A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA
B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.1 mol Na被完全氧化生成Na2O2,失去2 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
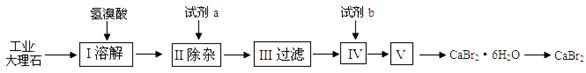
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr
500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、 ▲ 、 ▲ 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ▲ ,控制溶液的pH
约为8.0的目的是 ▲ 。步骤Ⅳ的目的是 ▲ 。
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、
干燥、称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 ▲ (保留两位小数)。
②若实验操作规范而测定结果偏低,其原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HC1O说法正确的是( )
A.电离程度:HCN>HClO
B.pH:HClO>HCN
C.NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(ClO--)>c(CN--)
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池组成正确的是( )
| 选项 | 正极 | 负极 | 电解质溶液 |
| A | Zn | Al | CuSO4 |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Cu | Zn | ZnCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com