
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
分析 A.根据金属活动顺序表,极少数的不活泼金属在自然界可以以游离态存在;
B.人类对金、银、铜、铁、铝的认识与金属的活动性有关,金属越活泼,越不容易以单质的形式存在,金属越不活泼,越容易在自然界中以单质形式存在;
C.根据保护金属资源途径、回收利用废旧金属的作用等进行分析;
D.金属提炼步骤分析,先要富集提高金属元素的含量,然后冶炼得到粗产品,再精炼.
解答 解:A.极少数的不活泼金属在自然界可以以游离态存在,如金,故A错误;
B.人类对金、银、铜、铁、铝的认识与金属的活动性有关,金属越活泼,人类开发利用该金属的时间就越晚,与其在自然界分布关系无关,故B错误;
C.对废旧金属的最好处理方法是回收、再用,这样可以节约金属资源,深埋会污染环境,资源浪费,故C错误;
D.有的矿物金属的含量较少,所以首先要富集;冶炼还原的金属有杂质,所以要进行精炼,故D正确;
故选D.
点评 本题考查了金属冶炼的一般原理,根据金属的活泼性不同选择不同的冶炼方法,不活泼金属采用直接加热法,非常活泼的金属采用电解法,大部分金属都是采用氧化还原法,注意知识的归纳和整理是关键,难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| B. | 将2mL 0.5mol/L Na2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA | |
| C. | 常温常压下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| D. | 25℃时,PH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
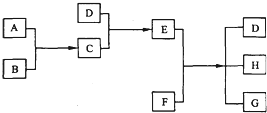
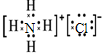
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
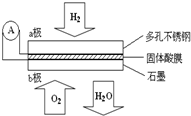 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由a极通过固体酸电解质传递到b极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数量KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 | |
| B. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com