
右图为氢气燃烧过程的能量变化曲线图(图中能量数据是在25℃、101kPa条件下测得)。据图回答问题:
(1)H2燃烧的热化学方程式为:
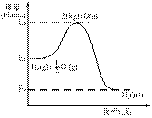
(2)反应过程中吸收的能量E吸= ,反应过程中释放的能量E放=
(3)电解1mol液态水需要消耗 kJ的电能。
(4)加快H2燃烧速率可采用的2种措施为 ;
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1= + 49.0 kJ·mol -1
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1= + 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H2=-192.9 kJ·mol -1
下列说法正确的是
A.根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成
CO2和H2O(l)放出的热量应大于192.9 kJ
B.反应②中的能量变化如右图所示,则△H2= E1- E3
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.CH3OH的燃烧热△H=-192.9 kJ·mol -1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省吉林一中高一4月月考化学试卷(带解析) 题型:填空题
据新华社2009年5月9日电, 国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义。请回答下列问题:
(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质。请回答下列问题。
①下列说法不正确的是 。
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:
MnFe2O4 MnFe2O4-X+(X/2)O2
MnFe2O4-X+(X/2)O2
则第二步反应的化学方程式为 (条件不写)。
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是 。
A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e—=Ni(OH)2+OH—
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据。已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3。
| 物质 | H2 | CO | CH4 |
| 热值/kJ·g–1 | 143 | 10 | 56 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省高三下学期第一次月考化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)? △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)??? △H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g)????? △H3=-867kJ·mol-1
则△H2=???????????????? 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为??? C(s) + H2O(g)= CO(g) + H2(g),
该反应的化学平衡常数表达式为K=???????????????????? 。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将????? 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是??????? (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将????? 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是??????? (填符号)。
a加入催化剂 ???? b降低温度?? ? c缩小容器体积 ???? d减少CO2的量

(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应???????????????????????? 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是??????????????? 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:

通入a气体的电极是原电池的? ??? (填“正”或“负”),
其电极反应式为? ??? ???? ????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ. 化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1) 将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为
C(s) + H2O(g) == CO(g) + H2(g)
该反应的化学平衡常数表达式为K= 。
800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
 |
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:

通入a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com