SnCl
4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl
2反应生成SnCl
4.
第一步:金属Sn的制备--以锡石SnO
2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为:
,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
Sn2++2e-=Sn
Sn2++2e-=Sn
.
第二步:SnCl
4的制备--用干燥、纯净的Cl
2与熔融的Sn反应制SnCl
4,同时放出大量的热.已知SnCl
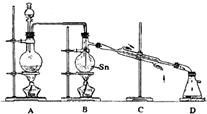
4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,右图是制取SnCl
4的实验装置.
试回答以下问题:
(1)装置A中反应的化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
;
(2)当反应生成SnCl
4时,应熄灭
B
B
处的酒精灯,理由是
依靠反应放出的热量维持Sn的熔化
依靠反应放出的热量维持Sn的熔化
;
(3)装置B的主要缺点是
缺少温度计
缺少温度计
,装置D的主要缺点是
装置D后应连接一个装有碱石灰的干燥管
装置D后应连接一个装有碱石灰的干燥管
;
(4)即使装置B和装置D进行改进后,老师说该实验装置设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称)并在下边方框中画出.


 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
 .
.


 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.