
【题目】在国际环境问题中,一次性使用的聚苯乙烯材料的“白色污染”甚为突出,这种材料难以分解,处理麻烦。最近研制出了一种新型的材料![]() 能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
A.聚乳酸是一种纯净物
B.其聚合方式与聚苯乙烯相似
C.其单体为![]()
D.聚乳酸是一种线性高分子材料
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )
A.1:1 B.2:1 C.3:2 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。

(1)该反应为 热反应,原因是 。
(2)下列能说明该反应已经达到平衡状态的是 (填序号)
A.v(H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。 达平衡时容器内平衡时与起始时的压强之比 。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明苯酚具有弱酸性的实验是()
A. 加入浓溴水生成白色沉淀
B. 苯酚钠溶液中通入CO2后,溶液由澄清变浑浊
C. 浑浊的苯酚加热后变澄清
D. 苯酚的水溶液中加NaOH溶液,生成苯酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①______________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
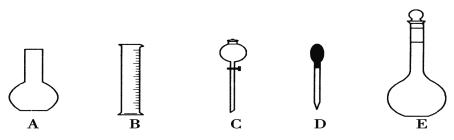
(2)根据计算用托盘天平称取NaOH的质量为③________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为⑤________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用⑥________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下三个热化学方程式:
2H2(g)+O2(g)=2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)=2H2O(l) 放热Q2 kJ
H2(g)+1/2O2(g)=H2O(g) 放热Q3 kJ,其中Q1 Q2 Q3 大小关系是
A.Q1=Q2=Q3 B.2Q3=Q1<Q2
C.Q3<Q2<Q1 D.Q1<Q2<3Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。

(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是___________。
(2)电动搅拌棒的作用是_________。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-)。
① ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图
 所示
所示
② 当pH≤2.0时,ClO2-也能被I-还原成Cl-
③ 2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0; ;再重复上述操作1~2次,计算得出结果。
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.离子晶体在熔化状态下一定能导电
B.分子晶体的状态变化只需克服分子间作用力
C.金属键的本质是金属离子与自由电子间的相互作用
D.原子晶体中只存在非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com