
【题目】相对分子质量为 M 的气态化合物V L(标准状况),溶于m g 水中,得到质量分数为 w、物质的量浓度为c mol/L、密度为ρg/mL 的溶液,下列说法正确的是
A. 溶液密度ρ=cw/1000M B. 物质的量浓度c=ρV/(MV+22.4m)
C. 溶液的质量分数w=MV/22.4m D. 对分子质量M=22.4mw/(1—w)V
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰氧(NOCl)是有机合成中的重要试剂,工业上可由NO与Cl2反应制得,回答下列问题:
(1)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰气,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) ΔH1 K1;
NaNO3(s)+NOCl(g) ΔH1 K1;
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 K2;
2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 K2;
2NO(g)+Cl2(g)![]() 2NOCl(g) ΔH3 K3;
2NOCl(g) ΔH3 K3;
则ΔH3=_____(用ΔH1和ΔH2表示),K3=______(用K1和K2表示)
(3)25℃时,向2L带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g)=2NOCl(g)ΔH
①测得其压强(p)随时间(t)的变化如图I曲线a所示(反应达到平衡时的温度与起始温度相同),则ΔH___0(填“>”或“<”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图I曲线b所示,则改变的条件是______。
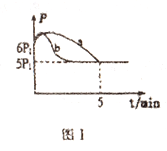
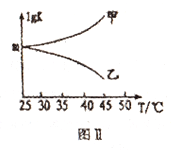
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是______ (填“甲”或“乙”);m值为_______
(4)NO可用间接电化学法除去,其原理如图3所示
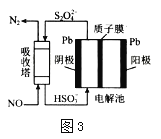
①阴极的电极反应式为_________
②吸收塔内发生反应的离子方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
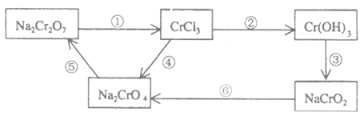
(1)配平并回答问题,用单线桥标出2个反应的电子转移的方向和数目。
反应①为:__Na2Cr2O7+__HCl→__NaCl+__CrCl3+__Cl2↑+____,氧化剂_______,氧化产物__________。
反应⑥为:__ClO3-+__CrO2-+____→__Cl-+__CrO42-+__H2O,还原剂________,还原产物__________。
(2)在上述有编号的步骤中,除了①⑥外,需用氧化剂的步骤是(填编号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类中依次按照强电解质、弱电解质和非电解质排列全部正确的组合是()
A.NaCl HF Cl2B.NaHCO3 NH3·H2O CCl4
C.Ba(OH)2 HCl CuD.AgCl H2SO4 C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,2.24L 四氯化碳含有的分子数目为 0.1NA
B. 25℃时,0.1 mol·L-1Na2S溶液中含有Na+的数目为0.2NA
C. 64g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
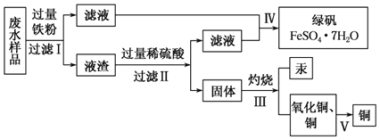
(1)步骤Ⅰ中加入过量铁粉的目的是_______________________________。
(2)步骤Ⅱ中________(填“能”或“不能”),用盐酸代替硫酸,写出步骤Ⅱ中涉及反应的化学方程式:____________________________________。
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩______________、______________、洗涤、干燥。现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是___________。
(4)步骤 V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案_________不好;从产品纯度考虑,方案_________不好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)![]() CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。
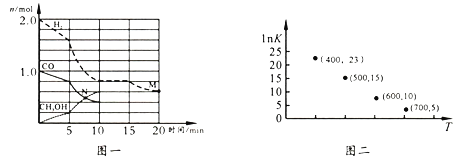
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
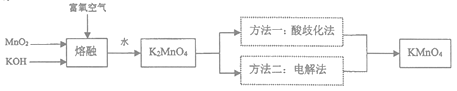
【题目】KMnO4是一种重要的氧化剂,广泛用于化学分析和化工生产以反水处理工业。工业上可由软锰矿(主要成分为MnO2)制备,目前有两种较为成熟的制法。其模拟流程如下图所示:
附表:不同温度下若干常见钾的化合物的溶解度(单位:g/(100gH2O))
化学式 | 20°C | 30°C | 40°C | 60°C | 80°C | 100°C |
CH3COOK | 256 | 283 | 324 | 350 | 381 | |
K2SO4 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 24.1 |
KCl | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 56.3 |
KMnO4 | 6.34 | 9.03 | 12.6 | 22.1 | ||
K2CO3 | 111 | 114 | 117 | 127 | 140 | 156 |
(1)“熔融”时,可用作坩锅材质的是________________(填序号)。
A.氧化铝 B.陶瓷 C.氧化镁 D.石英
(2)写出MnO2和KOH熔融物中通入富氧空气时获得K2MnO4的化学方程式______________________。
(3)“酸歧化法”是在pH<6的情况下K2MnO4即可转化为MnO2和KMnO4,过滤除去MnO2,将滤液经过蒸发浓缩、趁热过滤得到KMnO4粗晶体,再经过重结晶获得较纯净的KMnO4晶体;
①根据表中的溶解度数据以及上述操作的特点,“酸歧化法”不适宜选择的酸性物质是________。
A.稀硫酸 B.醋酸 C.稀盐酸 D.二氧化碳
②“蒸发浓缩”时,温度需控制在70℃,适宜的加热方式是________________。
③根据相关方程式,计算“酸歧化法”的理论产率为_________________。
(4)“电解法”克服了“酸歧化法”理论产率偏低的问题,同时副产品KOH可用于软锰矿的焙烧。电解法制备高锰酸钾的实验装置示意图如下(图中阳离子交换膜只允许K+离子通过)
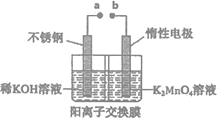
①a为______极(填“正”或“负”),右室发生的电极反应方程式为_______________。
②若电解开始时阳极区溶液为1.0L0.40mol·L-1K2MnO4溶液,电解一段时间后,右室中n(K)/m(Mn)为6:5,阴极区生成KOH的质量为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com