

| A. | 虚线代表的是使用了催化剂的反应的图象,该反应是吸热反应 | |
| B. | E1、E2是该反应在不同条件下的活化能,E4、E5是反应在不同条件下放出的能量 | |
| C. | 两种条件下反应的热效应相同,且虚线代表的反应速率较快 | |
| D. | 该反应的△H=E1-E5=E2-E4=E3 |
分析 A、催化剂降低活化能,加快反应速率,依据反应物和生成物能量变化判断反应吸热放热;
B、依据图象分析判断,E1、E2是该反应在不同条件下的活化能,E4、E5是其逆反应在不同条件下的活化能;
C、催化剂改变反应速率,降低活化能,不能改变反应的方向和焓变;
D、依据图象分析判断,△H=E1-E5=E2-E4=-E3.
解答 解:A、催化剂降低活化能,加快反应速率,反应物的能量高于生成物的能量,是放热反应,所以虚线代表的是使用了催化剂的反应的图象,该反应是放热反应,故A错误;
B、依据图象分析判断,E1、E2是该反应在不同条件下的活化能,E4、E5是其逆反应在不同条件下的活化能,故B错误;
C、催化剂改变反应速率,降低活化能,不能改变反应的方向和焓变,所以两种条件下反应的热效应相同,且虚线代表的反应速率较快,故C正确;
D、依据图象分析判断,△H=E1-E5=E2-E4=-E3,故D错误;
故选:C.
点评 本题考查了反应焓变的计算判断,图象分析是关键,反应自发进行的判断依据,催化剂的作用分析是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量的浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平秤取25.20g NaCl | |
| C. | 用100mL 量筒量取5.2mL 盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,将量取的浓盐酸倒入容量瓶中,加水稀释到刻度线即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L的 Na2S溶液中S2-的个数为0.1NA | |
| B. | 标准状况下,11.2LH2所含的中子数为0.15 NA | |
| C. | 7.8g Na2O2与足量的水反应,转移的电子数为0.2 NA | |
| D. | 1mol羟基所含电子数为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣实验小组用流水抽气管对教材中氢气在氯气中燃烧的实验进行了改进,可有效地防治Cl2、HCl对环境的污染,其实验装置如图所示:
某校化学兴趣实验小组用流水抽气管对教材中氢气在氯气中燃烧的实验进行了改进,可有效地防治Cl2、HCl对环境的污染,其实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释或解决方法 |
| A | 大量的燃煤、燃油是形成雾霾的主要原因, | 发展核能等清洁能源,减少化石燃料的使用 |
| B | “地沟油”是被氧化、分解的油脂,禁止食用 | 采用化学技术处理后代替汽油作燃料 |
| C | 氢氧化钠与氢氟酸都能与硅、二氧化硅反应 | 硅、二氧化硅都具有两性 |
| D | 漂白粉在空气中久置变质是 | 漂白粉中的有效成分与空气中的CO2反应生成CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
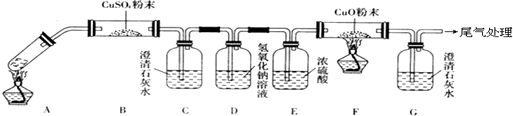
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2(l)=O2(g)+2H2O (l)△H=-196 kJ•mol-1 | |
| B. | 2N2(g)+O2(g)=2N2O(g)△H=+163 kJ•mol-1 | |
| C. | 2Ag(s)+Cl2(g)=2AgCl(s)△H=-254 kJ•mol-1 | |
| D. | 2HgO(s)=2Hg(l)+O2 (g)△H=+182kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com