
【题目】实验室铝热反应的实验装置如下:
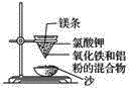
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
【答案】蒸发皿 镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应 镁条剧烈燃烧 三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒 “纸”漏斗的下部被烧穿,有熔融物落入沙中 2Al+Fe2O3![]() 2Fe+Al2O3 D 合理 NaOH溶液 有气泡放出 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ B
2Fe+Al2O3 D 合理 NaOH溶液 有气泡放出 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ B
【解析】
(1)用蒸发皿盛细沙,作用是防止蒸发皿炸裂;
(2)镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应;
(3)该反应的现象有①镁条剧烈燃烧,②三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒,③“纸”漏斗的下部被烧穿,有熔融物落入沙中;
(4)该反应为2Al+Fe2O3![]() 2Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
2Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
(5)①因该反应放出大量的热,能够使置换出的铁以液态析出,而铝的熔点比铁的低,易混杂在铁水中,冷却后得到合金;
②铝能够与氢氧化钠溶液反应产生氢气,而铁不能与氢氧化钠溶液反应,可用氢氧化钠溶液检验块状熔融物中是否含有金属铝;
③A、C中物质与熔融物反应产生污染空气的气体,而D中氢氧化钠溶液只能溶解铝,只有稀硫酸最合适。
(1)用蒸发皿盛细沙,作用是防止蒸发皿炸裂;
(2)镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应;
(3)该反应的现象有①镁条剧烈燃烧,②三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒,③“纸”漏斗的下部被烧穿,有熔融物落入沙中;
(4)该反应为2Al+Fe2O3![]() 2Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
2Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
(5)①解释合理;因该反应放出大量的热,能够使置换出的铁以液态析出,而铝的熔点比铁的低,易混杂在铁水中,冷却后得到合金;
②铝能够与氢氧化钠溶液反应产生氢气,而铁不能与氢氧化钠溶液反应,可用氢氧化钠溶液检验块状熔融物中是否含有金属铝;反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
③A、C中物质与熔融物反应产生污染空气的气体,而D中氢氧化钠溶液只能溶解铝,只有稀硫酸最合适。
答案选B。


科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5gZn放入足量的盐酸中,锌完全反应。计算:
(1)6.5gZn的物质的量?_________。
(2)参加反应的HCl的物质的量?_________。
(3)生成氢气的体积(标准状况)?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:电流效率=电路中通过的电子数÷消耗负极材料失去电子总数。现有三个电池装置如图所示:
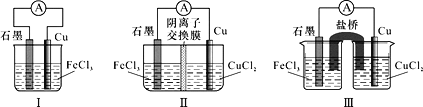
下列说法正确的是
A.Ⅰ、Ⅱ和Ⅲ的电池反应均为:Cu+Fe3+=Cu2++Fe2+
B.Ⅲ中烧杯里的Cl-从右池经过盐桥移向左池
C.5min后,Ⅰ、Ⅱ和Ⅲ中都只含两种溶质
D.Ⅱ、Ⅲ的电流效率均高于Ⅰ的电流效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
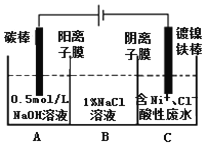
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
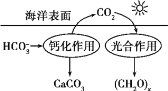
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式:___、___。
(2)在海洋碳循环中,通过如图所示的途径固碳。写出钙化作用的离子方程式:___。
Ⅱ、为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:

请回答:(1)X的化学式是____。
(2)绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___。
(3)加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )

A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】唑啉草酯H是用于麦田的具有新颖结构的苯基吡唑啉除草剂。一种合成路线如下:
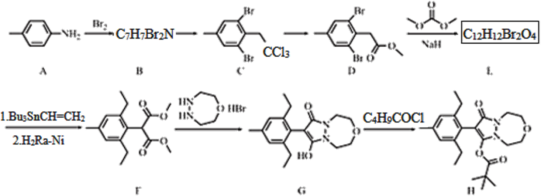
回答下列问题:
(1)A的化学名称为__________
(2)B的结构简式为__________
(3)G→H的反应类型为__,下列关于G、H的说法正确的是______(填选项字母)。
A.G不含手性碳原子,H含有一个手性碳原子
B.二者均能使酸性KMnO4溶液褪色
C.二者均含有3种含氧官能团
D.二者各1mol时,最多消耗H2的物质的量不相等
(4)写出D→E的化学反应方程式:__________.
(5)同时满足下列条件的F的同分异构体Ⅰ的结构有________种(不考虑立体异构),写出两种核磁共振氢谱显示有3种不同化学环境的氢,且峰面积之比为9:1:1的Ⅰ的结构简式:_________________
①苯环上连有2个相同的叔丁基[-C(CH3)3]②苯环上只有2个H③1molⅠ能与2molNaHCO3反应产生无色气体
(6)已知:CH2=CH-R1+HBr→R1-CHBr-CH3,CH2=CH-R1+HBr![]() R1-CH2-CH2Br结合题给信息,写出以2-甲基-1-丙烯和
R1-CH2-CH2Br结合题给信息,写出以2-甲基-1-丙烯和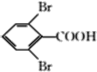 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物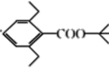 的合成路线:____________。
的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中发生的反应的化学方程式是________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是_______。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________,该反应的离子方程式是_____________,该反应属于四种基本反应类型中的__________反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com