
 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.| 实验序号 | 起始温度t1℃ | 终止温度t1℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
分析 (1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据仪器的结构可知,仪器A是环形玻璃搅拌棒;根据中和热测定实验成败的关键是保温工作;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=cm△T计算出反应放出的热量,最后计算出生成1mol水放出的热量,就可以得到中和热;
(4)a.装置保温、隔热效果差,测得的热量偏小;
b.将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失;
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液温度,盐酸的起始温度偏高;
解答 解:(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol,
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)仪器A是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;减少实验过程中的热量损失;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:23.6℃,反应前后温度差为3.05℃;
三组数据均有效,平均温度差为3.1℃,40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液的质量和为m=80mL×1g/cm3=80g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×80g×3.1℃=1.036kJ,即生成0.02mol的水放出热量为:1.036kJ,所以生成1mol的水放出热量为1.036kJ×$\frac{1mol}{0.02mol}$=-51.8kJ/mol,即该实验测得的中和热△H=-51.8kJ/mol;
故答案为:-51.8kJ/mol;
(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.把NaOH溶液迅速倒入盛有稀硫酸的小烧杯中,能减少热量的损失,操作正确,故b错误;
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故c正确;
故选:ac.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法以及测定反应热的误差等问题.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Cl$→_{△}^{NaOH溶液}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl | |
| B. | CH3CH2Cl$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl | |
| C. | CH3CH2Cl$→_{△}^{NaOH的醇溶液}$CH2═CH2$\stackrel{HCl}{→}$CH3CH2Cl$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl | |
| D. | CH3CH2Cl$→_{△}^{NaOH的醇溶液}$CH2═CH2$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和N2 | B. | CO2和NO2 | C. | CO2和O2 | D. | CO2、N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体CuO加入稀H2SO4中 CuO+2H+=Cu2++H2O | |
| B. | 盐酸滴加在石灰石上 CaCO3+2H+=Ca2++H2CO3 | |
| C. | Ba(OH)2溶液与稀硫酸混合 Ba2++SO42-=BaSO4↓ | |
| D. | 铜片加入稀盐酸中 Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
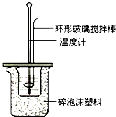 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com