
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
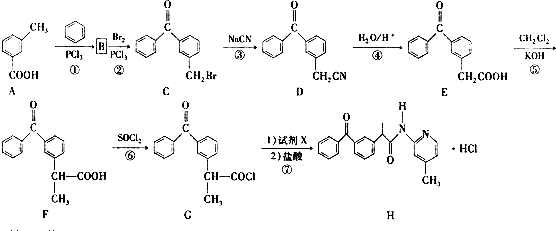
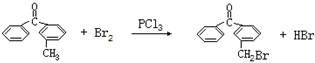 .
.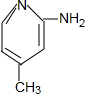 .
.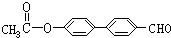 、
、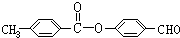
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
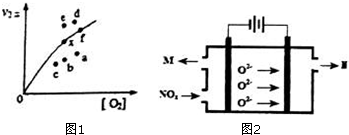 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知查看答案和解析>>
科目:高中化学 来源: 题型:选择题
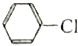 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
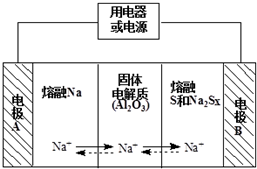 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )| A. | 放电时,内电路中的Na+的从B向A移动 | |
| B. | 充电时,电极A接电源的正极 | |
| C. | 充电时,总反应为2Na+xS=Na2Sx | |
| D. | 放电时,正极的电极反应式为xS+2e-=Sx2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分解的热化学方程式为H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1 | |
| B. | 反应速率与Fe2+浓度有关 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | △H1+△H2=196 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:
某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com