
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | HD、HCHO都是极性分子 | D. | 干冰、可燃冰都是分子晶体 |
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2═C(CH3)2和CH3CH═CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2CH2COOH和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| B. | 17.4 g某硫化磷(如图)中含P-S键数目为0.6NA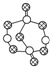 | |
| C. | 1 mol含8个碳原子的某烃分子,最多形成7 mol碳碳单键 | |
| D. | 标准状况下,22.4 L SO2与O2混合气体,含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E单质从HE的溶液中置换出来 | |
| B. | A、H、J的离子半径由大到小顺序是A>J>H | |
| C. | G元素的单质不存在同素异形体 | |
| D. | I在DB2中燃烧生成两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com