
铁盐在工业、农业、医药等领域有重要的价值。
(1)将55.600g绿矾(FeSO4∙7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为 g;SO2为 mol。
(2)实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
Ⅰ.将4.400g铁屑(含Fe2O3)与25mL3mol/L H2SO4充分反应后,得到 FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。
①铁屑中Fe2O3的质量分数是 (保留两位小数)。
Ⅱ.向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。
②t℃时,(NH4)2SO4·FeSO4·6H2O的溶解度是 g/100g水(保留两位小数)。
(3)黄铁矾是难溶于水且不含结晶水的盐,它由两种阳离子和两种阴离子构成。工业上常用生成黄铁矾的方法除去溶液中的Fe2+,原理是:用氧化剂将Fe2+氧化为Fe3+,Fe3+的水解产物与溶液中某些离子一起生成黄铁矾沉淀。
实验室模拟工业过程的操作如下:
向1L 0.0500mol/L的稀硫酸中加入16.680g绿矾,完全溶解后,依次加入1.065gNaClO3(式量106.5)和1.610gNa2SO4∙10H2O(式量322),充分反应后,得到9.700g黄铁矾沉淀。所得无色溶液中含有的H+为0.16 mol,SO42—为0.075 mol,Cl—为0.01mol。
计算并确定黄铁矾的化学式。
(1)16(3分);0.1(3分)
(2)①0.36(或36%)(3分) ②22.51(3分)
(3)NaFe3(SO4)2(OH)6(4分)
【解析】
试题分析:
(1)绿矾(FeSO4∙7H2O,式量为278)在高温下加热分解的方程式为2FeSO4∙7H2O==Fe2O3+SO2+SO3+7H2O,设生成氧化铁的质量是x,二氧化硫的物质的量为y,

Ⅰ、根据题意知,溶液中还有酸剩余,剩余的n(H2SO4)=0.1mol/L×0.5×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol,设铁的物质的量是m,氧化铁的质量是n,
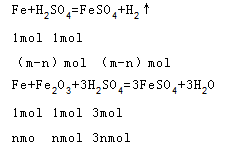
(SO4)2(OH)6.
考点:本题涉及物质的量、质量分数等有关计算,难度较大,注意Ⅰ、(1)中铁不仅和稀硫酸反应,还和铁离子反应,往往容易漏掉该反应而导致错误,为易错点.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为 L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验 | 序号样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测,1.81 g样品进行同样实验时,生成氨气的体积(标况)为________ L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(3)求所有NaOH溶液的物质的量浓度为___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省宁德市高三1月单科质量检查考试化学试卷(解析版) 题型:填空题
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式??????????????????????? ,第二步的电离平衡常数表达式Ka2=?????????????? 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是???????????? 。
①I-???????????? ②Fe3+????????????? ③Cu2+??????????? ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式:?????????????????? 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:
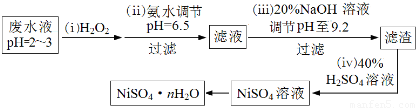
①第(ⅰ)步,加入H2O2反应的离子方程式?????????????????? 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是???????????????? 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为?????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com