
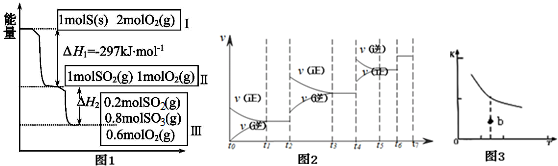
分析 (1)1molS完全燃烧放出297kJ热量,据此书写热化学方程式;
(2)根据2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1知,2mol二氧化硫完全反应生成196.6kJ热量,据此计算(1-0.2)mol=0.8mol二氧化硫完全反应放出的热量;
(3)该反应的正反应是放热反应,恒温恒容时,相当于增大压强,平衡正向移动,二氧化硫转化率增大;
(4)a.该反应的正反应是放热反应,升高温度平衡影响移动;
b.充入He气,二氧化硫、氧气和三氧化硫的浓度不变,平衡不移动;
c.再充入1molSO2(g)和1molO2(g),相当于增大压强,平衡正向移动;
d.使用催化剂平衡不移动;
(5)t4时,正逆反应速率都增大,且逆反应速率增大倍数大于正反应增大倍数,平衡逆向移动;
化学平衡常数只与温度有关,该反应中升高温度平衡常数降低;
(6)该图中曲线为平衡常数与温度之间关系平衡曲线,b点浓度商小于该温度下的K,要使b点达到平衡状态,则平衡正向移动.
解答 解:(1)1molS完全燃烧放出297kJ热量,据此书写热化学方程式为硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 kJ•mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 kJ•mol-1;
(2)由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ•mol- 1;可知,△H2=0.4△H=0.4×-196.6kJ•mol- 1=-78.64kJ•mol-1;
故答案为:-78.64kJ•mol-1 ;
(3)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大;
故答案为:大;
(4)a、反应为放热反应,温度升高,平衡逆向移动,n(SO3)减小,n(SO2)增大,n(SO3)/n(SO2)减小,故a错误;
b、恒容条件下,充入氦气,反应混合物浓度不变,平衡不移动,n(SO3)/n(SO2)不变,故b错误;
c、再充入1molSO2(g)和1molO2 (g),等效为Ⅱ压强增大一倍,平衡正向移动,n(SO3)/n(SO2)增大,故c正确;
d、使用催化剂,加快反应速率,平衡不移动,n(SO3)/n(SO2)不变,故d错误.
故答案为:c;
(5)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动.t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动;该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度,t6~t7是加入催化剂,平衡常数随温度变化,不随浓度、压强、催化剂等条件改变,反应是放热反应,升温平衡逆向进行,平衡常数减小;平衡常数为K1=K2>K4=K3;
故答案为:升高温度;K1=K2>K3=K4 ;
(6)b点小于平衡状态,若达到平衡状态,平衡正向移动,所以v(正)>v(逆);
反应焓变和起始物质和终了物质能量有关,与变化过程无关,所以温度不变、反应焓变不变;
故答案为:>;不变.
点评 本题考查化学平衡有关计算、外界条件对化学平衡移动影响、热化学方程式的书写等知识点,为高频考点,注意:平衡常数只与温度有关,与物质浓度、压强都无关,易错点是(4)b,只有改变条件能引起反应物或生成物浓度变化时才能使平衡发生移动,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 山西王家岭煤矿3•28透水事故被困工作在井下靠吃木屑、树皮,喝凉水维持生命.木屑、树皮的化学成分主要是纤维素 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 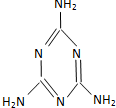 广为人知的奶粉事件中的罪魁祸首为三聚氰胺(结构如图)其摩尔质量为126g | |
| D. | 2010年4月支援青海玉树地震灾区的生活用品中的食醋、纯碱、食盐,其对应的主要化学物质分别属于酸、碱、盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和
| 类别 | 同位素 | 同素异形体 | 同分异构体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠能与盐酸反应,可用作治疗胃酸过多的药剂 | |
| B. | 氧化铝具有很高的熔点,可制耐高温耐火材料 | |
| C. | 常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸 | |
| D. | 钠具有极强的还原性,可用钠与CuCl2溶液反应制取铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①② | C. | ②④ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com