在一定温度下,体积为2L的密闭容器中,NO
2和N
2O
4之间发生反应:N
2O
4(g)
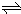
2NO
2 (g),如图所示.
(1)曲线______ (填“X”或“Y”)表示NO
2的物质的量随时间的变化曲线.
(2)若升高温度,则v(正)______,v(逆)______(填“加快”或“减慢”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲
中v(NO
2)=0.3mol?L
-1?min
-1,乙中v (N
2O
4)=0.2mol?L
-1?min
-1,则______中反应更快.
(4)在0到1min中内用X表示该反应的速率是______,该反应达最大限度时,Y的转化率______,反应开始时与反应达平衡状态时的压强之比为______.
(5)下列描述能表示反应达平衡状态的是______.
A.容器中X与Y的物质的量相等B.容器内气体的颜色不再改变
C.容器的压强保持一定D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1mol N
2O
4完全转化为2mol NO
2 (g)时吸收QKJ的热量,在一密闭容器中充入2mol NO
2 (g),容器内温度______(升高、降低或不变).达到反应限度时反应产生的热量______QKJ(大于、小于或等于).

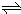


 备战中考寒假系列答案
备战中考寒假系列答案 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应: 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g)
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g) 2NO2 (g),如图所示.
2NO2 (g),如图所示.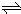 2NO2 (g),如图所示.
2NO2 (g),如图所示.