
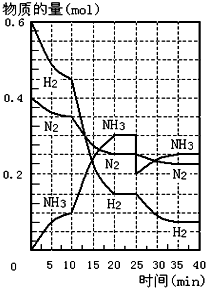
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:分析 (1)根据图象结合反应处于平衡状态的时各物质的量不变分析;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算;
(3)据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,据此判断.
解答 解:(1)因为反应处于平衡状态的时各物质的量不变,所以根据图象,500℃、20MPa时,反应处于平衡状态的时间段20~25min,35~40min,故答案为:20~25min,35~40min;
(2)由图象可知,反应开始到第一次平衡时,N2的物质的量从0.4mol减少到0.25mol,所以反应速率v(N2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.4-0.25}{2}}{20}$=0.00375mol/(L.min),故答案为:0.00375mol/(L.min);
(3)由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂;
第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
故答案为:使用催化剂;分离出NH3.
点评 本题考查反应速率的计算、平衡移动以及平衡状态的判断,综合性强,侧重反应原理的考查,注意对图象的分析,是高考中的常见题型,试题基础性强,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
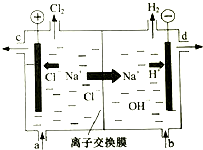 工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.
工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=+890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com