
【题目】(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验编号 | 0.01mol·L-1 酸性KMnO4溶液 | 0.1mol·L-1 H2C2O4溶液 | 水 | 1mol·L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
I | 2mL | 2mL | 0 | 0 | 20 | 125 |
II | ____mL | ____mL | 1mL | 0 | 20 | 320 |
III | ____mL | __ _mL | ___mL | 0 | 50 | 30 |
IV | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至___ ___ __时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 + H2C2O4 + H2SO4= K2SO4 + MnSO4 + CO2↑+ H2O
【答案】(1)溶液紫红色刚好褪色
(2)
(3)催化剂 (4)2 5 3 1 2 10 8
【解析】
试题(1)高锰酸钾溶液呈紫色,反应使高锰酸钾褪色;(2)实验I和II研究浓度对反应速率的影响,,溶液的总体积相同,所以实验II 加2mL0.01mol·L-1酸性KMnO4溶液、1mL0.1mol·L-1H2C2O4溶液;实验I和III研究温度对反应速率的影响,投料应该相同,所以实验III 加2mL0.01mol·L-1酸性KMnO4溶液、2mL0.1mol·L-1H2C2O4溶液,0 mL水;(3)实验IV比实验I多加了两滴MnSO4,研究催化剂对反应的影响;(4)根据化合价升降相同,所以化学方程式为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s)![]() 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
反应温度/℃ | 800 | 800 | 850 |
c(A)起始/mol·L-1 | 1 | 2 | 1 |
c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,c(![]() )由大到小的顺序是________。
)由大到小的顺序是________。
A.0.2mol·L-1NH4Cl溶液 B.0.2mol·L-1NH4HCO3溶液
C.0.2mol·L-1NH4HSO4溶液 D.0.1mol·L-1(NH4)2Fe(SO4)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X。

请回答:
(1)下列说法正确的是_________。
A.化合物B不能使溴水褪色
B.化合物C能与CuO发生氧化反应
C.化合物D的分子式是C9H10O2Br
D.化合物E到F发生的是加成反应
(2)化合物H的结构简式是________。
(3)已知I→X是取代反应,写出该反应的化学方程式________。
(4)化合物G的同分异构体有以下特征:①含有苯环;②1H﹣NMR谱显示分子中有3种氢原子;③分子结构中不存在氧氧键。请写出所有符合要求的结构简式(或键线式)___。
(5)已知:① ;②
;② ,请结合题目中已知信息设计由
,请结合题目中已知信息设计由![]() 合成
合成![]() 的路线________________________(用流程图表示)。
的路线________________________(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
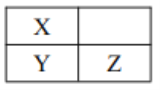
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2NO(g)+O22NO2(g),在其他条件相同时,测得实验数据如图。请根据图示数据,下列有关该反应的说法正确的是( )

A. 相同条件下,化学反应速率随时间越来越快
B. 相同条件下,压强越大,化学反应速率越快
C. 相同条件下,温度越高,化学反应速率越快
D. 在0.1MPa、90℃条件下,反应20s时达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员将Cu与Cu2O的混合物ag,用足量的稀H2SO4充分反应后,剩余固体质量为bg。
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)混合物中n(Cu2O)=________mol(用含a、b的最简式表示)
(2)若将ag混合物在空气中加热生成CuO,则m(CuO)=_______g(用含a、b的最简式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。

查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示与对应的叙述符合的是
A. 如图可知实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化

B. 如图可知,反应C(金刚石,s) ══ C(石墨,s)的焓变ΔH ══ ΔH1-ΔH2

C. 如图可知表示除去氧化膜的镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应

D. 如图可知表示25℃时用0.1000 mol·L-1醋酸滴定40.00 mL 0.1000 mol·L-1NaOH溶液得到的滴定曲线

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com