
| A. | 一分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1mol H2和Cl2完全反应生成2mol HCl放出的热量为184.6kJ | |
| C. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,放出的热量为184.6 kJ | |
| D. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,吸收的热量为184.6kJ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
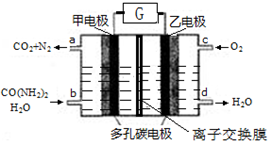
| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、Ba(NO3)2、NH4NO3、AgNO3 | B. | HNO3、NH4NO3、Ba(NO3)2、AgNO3 | ||
| C. | NH4NO3、HNO3、Ba(NO3)2、AgNO3 | D. | NH4NO3、HNO3、AgNO3、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
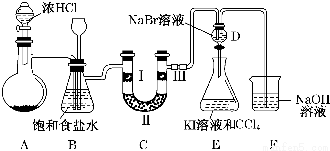
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 | |
| C. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
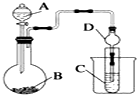
 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com