
科目:高中化学 来源: 题型:
2HCl+H2SeO4![]() H2SeO3+Cl2↑+H2O
H2SeO3+Cl2↑+H2O
然后向亚硒酸中通入SO2,生成粗硒。进一步提纯时,可往熔融的粗硒中通入氧气,使生成的氧化硒挥发,再转变成亚硒酸,还原为单质硒。
根据上述信息,回答下列问题:
(1)对盐酸与硒酸反应的下述判断中,正确的是( )
A.该反应是强酸制取弱酸的复分解反应 B.硒酸发生氧化反应
C.硒酸有强氧化性 D.盐酸在反应中是氧化剂
(2)对SeO2和SO2及它们的水化物,下列叙述不正确的是( )
A.SeO2和SO2均是酸性氧化物 B.SeO2和SO2均属于分子晶体类型
C.亚硫酸氧化性弱于亚硒酸 D.SO2与亚硒酸反应的物质的量比为1∶1
(3)下列关于硒的叙述中,不正确的是( )
A.硒在空气中燃烧生成SeO2,和钠反应生成Na2Se
B.硒化氢有恶臭味,有毒,比硫化氢易分解
C.硒化氢在空气中不能燃烧
D.亚硒酸(H2SeO3)是一种弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从含硒(Se)的废料中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸:
2HCl+H2SeO4![]() H2SeO3+Cl2↑+H2O
H2SeO3+Cl2↑+H2O
然后向亚硒酸中通入SO2,生成粗硒。进一步提纯时,可往熔融的粗硒中通入氧气,使生成的氧化硒挥发,再转变成亚硒酸,还原为单质硒。
根据上述信息,回答下列问题:
(1)对盐酸与硒酸反应的下述判断中,正确的是( )
A.该反应是强酸制取弱酸的复分解反应 B.硒酸发生氧化反应
C.硒酸有强氧化性 D.盐酸在反应中是氧化剂
(2)对SeO2和SO2及它们的水化物,下列叙述不正确的是( )
A.SeO2和SO2均是酸性氧化物 B.SeO2和SO2均属于分子晶体类型
C.亚硫酸氧化性弱于亚硒酸 D.SO2与亚硒酸反应的物质的量比为1∶1
(3)下列关于硒的叙述中,不正确的是( )
A.硒在空气中燃烧生成SeO2,和钠反应生成Na2Se
B.硒化氢有恶臭味,有毒,比硫化氢易分解
C.硒化氢在空气中不能燃烧
D.亚硒酸(H2SeO3)是一种弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。
①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
查看答案和解析>>
科目:高中化学 来源:2012届河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:单选题
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。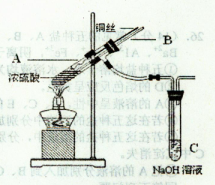
①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:选择题
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。

①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com