
Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:
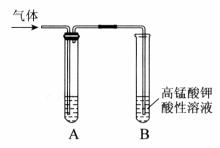
| 序号 | 气体 | 反应原理 | A中试剂 |
| ① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | ______________ |
| ② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________________ | NaOH溶液 |
| ③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 | ① | ② | ③ |
| 实验操作 |
|
|
|
| 实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________________。
【答案】Ⅰ. (1)①水;③NaOH溶液 ; (2)CH3CH2OH CH2==CH2↑+H2O;(3)CuSO4溶液
CH2==CH2↑+H2O;(3)CuSO4溶液
Ⅱ. (1)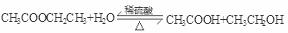
(2)稀硫酸可以加速酯的水解(或稀硫酸是酯水解反应的催化剂)
(3)乙酸乙酯水解生成的乙酸与NaOH发生中和反应,乙酸浓度降低,使水解平衡向正反应方向移动,水解比较彻底。
【解析】
试题分析:Ⅰ. (1)①溴乙烷和NaOH的醇溶液加热制取乙烯中含有乙醇蒸气,由于乙醇与水混溶,所以可以通过水来除去;③由于电石中含有CaS等杂质,所以电石与饱和食盐水反应产生的乙炔中含有的H2S,应该用NaOH溶液来除去;Ⅱ. (1)试管①中反应的化学方程式是 ;(2)对比试管①和试管③的实验现象,稀H2SO4的作用是稀硫酸可以加速酯的水解(或稀硫酸是酯水解反应的催化剂);(3)当溶液中存在NaOH时,由于产生的羧酸可以与碱NaOH发生中和反应,使酯的水解平衡向正向移动,最终水解彻底完全。
;(2)对比试管①和试管③的实验现象,稀H2SO4的作用是稀硫酸可以加速酯的水解(或稀硫酸是酯水解反应的催化剂);(3)当溶液中存在NaOH时,由于产生的羧酸可以与碱NaOH发生中和反应,使酯的水解平衡向正向移动,最终水解彻底完全。
考点:考查气体中杂质的除去方法、乙酸乙酯的水解反应原理及分析的知识。


科目:高中化学 来源: 题型:
[化学——选修2:化学与技术](15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为______________________________,产品2的化学式为__________,1 L浓海水最多可得到产品2的质量为________g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为________________________;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是
A.石 油裂解得到的汽油是纯净物
油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
用下图所示装置及药品进行相应实验,能达到实验目的的是
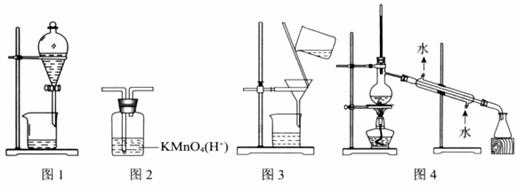
A. 图1 分离乙醇和乙酸 B. 图2 除去乙炔中的乙烯
C. 图3 除去溴苯中的溴单质 D. 图4 除去工业酒精中的甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某烃A分子的球棍模型。回答下列问题:
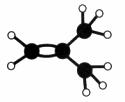
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
A. 氧化反应 B. 加成反应 C. 消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铅蓄电池进行电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极为Pb+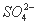 ====PbSO4+2e-,正极为PbO2+4H++
====PbSO4+2e-,正极为PbO2+4H++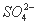 +2e-====PbSO4+2H2O,今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-====PbSO4+2H2O,今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将一直流电源的正、负极,用玻璃片分别压在一张用食盐水、碘化钾淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是( )
| A | B | C | D | |
| 阳极 | 蓝 | 白 | 红 | 蓝 |
| 阴极 | 白 | 蓝 | 蓝 | 蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
①w= ×100% ②c=
×100% ②c=
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(Cl-)>c(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是

A.32gS8分子中含有0.125molsp3- sp3σ键 B.SF6是由极性键构成的正八面体分子
C.1molHCN分子中有2molσ键和2molπ键 D.B12中仅含非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com