A
分析:A、NO
2和N
2O
4的中N原子与O原子的个数比都为1:2,以此计算;
B、稀盐酸不与二氧化锰发生氧化还原反应;
C、在氧化钠和过氧化钠中,Na元素的化合价都为+1价;
D、Fe
3+离子发生水解生成氢氧化铁.
解答:A、NO
2和N
2O
4的中N原子与O原子的个数比都为1:2,46gNO
2和N
2O
4含有的原子总数为
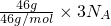
=3N
A,故A正确;
B、浓盐酸与二氧化锰发生氧化还原反应,随着浓度的降低,稀盐酸不与二氧化锰发生氧化还原反应,所以生成的氯气在标准状况下的体积小于22.4L,故B错误;
C、0.1mol金属钠与氧气在一定条件下发生反应,生成氧化钠和过氧化钠的混合物时,在氧化钠和过氧化钠中,Na元素的化合价都为+1价,则0.1molNa失电子数一定为0.1N
A,故C正确;
D、Fe
3+离子发生水解生成氢氧化铁,则1L1mol?L
-1硫酸铁溶液中含有Fe
3+离子数目小于0.2N
A,故D错误.
故选A.
点评:本题考查阿伏加德罗常数,题目难度不大,做题时注意物质的组成、结构、性质以及存在的状态和条件等问题.

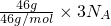 =3NA,故A正确;
=3NA,故A正确;

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案