
检验氯化氢气体中是否混有Cl2,可采用的方法是
A.用干燥的蓝色石蕊试纸
B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸
D.将气体通入硝酸银溶液中
科目:高中化学 来源: 题型:
一定体积的某气态烃与过量氧气的混合物充分反应后恢复到原温度、压强(标准状况),混合气体体积缩小了二分之一。下列四种气态烃中,符合条件的是
A.乙烷 B.乙烯 C.乙炔 D.丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反应的离子方程式 ▲ 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 ▲ g。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量
为 ▲ 。
Ⅱ、一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
请回答下列问题:
(4)判断该反应达到化学平衡状态的标志是 ▲ (填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(5) SO2的转化率 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组设计如图所示装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是
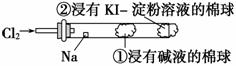
A.钠在氯气中燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是

A.浓H2SO4 B.NaOH溶液
C.浓盐酸 D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是
A.N2O B.NO
C.NO2 D.N2O5

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性。各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
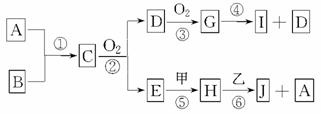
(1)写出反应②的化学方程式_________________________________________________。
(2)反应④中每消耗1 mol G,转移电子的物质的量为________。
(3)反应⑥的离子方程式为___________________________________________________。
(4)实验室中保存I的方法是_________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)实验室利用如右图装置进行中和热的测定。回答下列问题:
(1)该图中有两处实验用品未画出,它们是 、
;
(2)在操作正确的前提下提高中和热测定的准确性的关键是:
。
(3)如果用0.5mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中
和热”将 (填“偏大”、“偏小”、“不变”)原因是
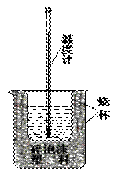 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com