
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种.
阴离子 | CO32﹣、SiO32﹣、AlO2﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 , ab段发生反应的离子是 , bc段发生反应的离子方程式为 .
(2)若Y是NaOH溶液,则X中一定含有的阳离子是 , 其物质的量之比为 , ab段反应的离子方程式为 .
【答案】
(1)AlO ![]() 、SiO
、SiO ![]() ;CO
;CO ![]() ;Al(OH)3+3H+=Al3++3H2O
;Al(OH)3+3H+=Al3++3H2O
(2)Al3+、Mg2+、NH4+;2:1:4;NH4++OH﹣═NH3?H2O
【解析】解:(1)某无色稀溶液X中,无色溶液中不会含有Fe3+ , 加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3 , 前者能溶于过量盐酸中而后者不能,所以由图象知溶液中含有SiO ![]() 、AlO2﹣;则oa段发生反应的离子为AlO
、AlO2﹣;则oa段发生反应的离子为AlO ![]() 、SiO
、SiO ![]() ;ab段发生的反应沉淀的量不变,所以ab段为盐酸与CO
;ab段发生的反应沉淀的量不变,所以ab段为盐酸与CO ![]() 反应,bc段沉淀减少,则是Al(OH)3溶解于盐酸,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O.所以答案是:AlO2﹣、SiO
反应,bc段沉淀减少,则是Al(OH)3溶解于盐酸,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O.所以答案是:AlO2﹣、SiO ![]() ;CO
;CO ![]() ;Al(OH)3+3H+=Al3++3H2O;(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO
;Al(OH)3+3H+=Al3++3H2O;(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO ![]() 、SiO
、SiO ![]() 、AlO
、AlO ![]() ,由于溶液一定要保持电中性,故溶液中一定含Cl﹣;当a﹣b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH
,由于溶液一定要保持电中性,故溶液中一定含Cl﹣;当a﹣b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH ![]() +OH﹣═NH3H2O,即溶液中含NH
+OH﹣═NH3H2O,即溶液中含NH ![]() ;当b﹣c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+ , 即bc段的反应为:Al(OH)3+OH﹣═AlO2﹣+2H2O.即则X中一定含有的离子是Al3+、Mg2+、NH
;当b﹣c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+ , 即bc段的反应为:Al(OH)3+OH﹣═AlO2﹣+2H2O.即则X中一定含有的离子是Al3+、Mg2+、NH ![]() 、Cl﹣;由于溶液中有Al3+、Mg2+ , 故oa段转化为沉淀的离子是Al3+、Mg2+ , ab段是氢氧化钠和铵根离子反应生成气体,反应的离子方程式为NH4++OH﹣═NH3H2O;溶液中有Al3+、Mg2+ , 即沉淀中含Al(OH)3和Mg(OH)2 , 故bc段的反应为:Al(OH)3+OH﹣═AlO
、Cl﹣;由于溶液中有Al3+、Mg2+ , 故oa段转化为沉淀的离子是Al3+、Mg2+ , ab段是氢氧化钠和铵根离子反应生成气体,反应的离子方程式为NH4++OH﹣═NH3H2O;溶液中有Al3+、Mg2+ , 即沉淀中含Al(OH)3和Mg(OH)2 , 故bc段的反应为:Al(OH)3+OH﹣═AlO ![]() +2H2O, NH4+反应需要NaOH的体积是2V,由于Al(OH)3溶解时需要的NaOH的体积是V,则生成Al(OH)3需要的NaOH的体积是3V,而生成Mg(OH)2和Al(OH)3共消耗NaOH的体积为4V,则生成Mg(OH)2需要NaOH溶液的体积是V,则n(Al3+):n(Mg2+):n(NH4+)=2:1:4,所以答案是:Al3+、Mg2+、NH4+;2:1:4;NH4++OH﹣═NH3H2O.
+2H2O, NH4+反应需要NaOH的体积是2V,由于Al(OH)3溶解时需要的NaOH的体积是V,则生成Al(OH)3需要的NaOH的体积是3V,而生成Mg(OH)2和Al(OH)3共消耗NaOH的体积为4V,则生成Mg(OH)2需要NaOH溶液的体积是V,则n(Al3+):n(Mg2+):n(NH4+)=2:1:4,所以答案是:Al3+、Mg2+、NH4+;2:1:4;NH4++OH﹣═NH3H2O.


科目:高中化学 来源: 题型:
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
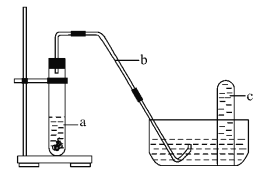
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
【答案】 100mL容量瓶 10.0 AC Cu(NO3)2 装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】(1)实验室没有95mL规格的容量瓶,必须配制100mL,配制100mL1.0molL-1的硝酸溶液步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器有:烧杯、玻璃棒、100ml容量瓶、胶头滴管,所以需要的玻璃仪器是:100mL容量瓶;(2)配制100mL1.0molL-1的硝酸溶液,设需要10molL-1的浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:100mL×1.0molL-1=10molL-1×V,解得V=10mL;(3)A.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,选项A选;B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏低,选项B不选;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项C选;D.容量瓶用蒸馏水洗涤后未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,选项D不选;E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯,则相当于所量硝酸偏多,导致所配溶液浓度偏大,选项E不选。答案选AC;(4)①铜与硝酸反应生成硝酸铜,化学式为Cu(NO3)2;②装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2,即使开始没有NO2而只有NO气体也可能变成红棕色,反应初期试管上方有浅红棕色气体出现;
③二氧化氮能够与水反应生成硝酸和一氧化氮,反应方程式:3NO2+H2O = 2HNO3+NO,所以红棕色气体在试管c中颜色消失。
点睛:本题考查了一定物质的量浓度溶液的配制及硝酸性质探究,明确配制原理及操作步骤,熟悉硝酸的性质是解题关键,易错点为(4)①铜与硝酸反应生成硝酸铜,硝酸铜为蓝色溶液;②依据一氧化氮能够与空气中氧气反应生成二氧化氮解答;③依据二氧化氮能够与水反应生成硝酸和一氧化氮解答。
【题型】综合题
【结束】
29
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:
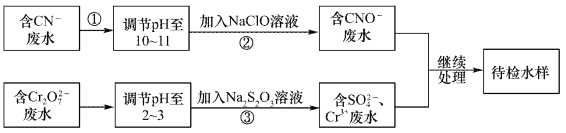
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子的核外电子排布,下列说法正确的是( )
A.M层为最外层时,最多可容纳18个电子
B.在K层上运动的电子能量最高
C.次外层上最多可容纳32个电子
D.N层上最多可容纳32个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硝酸见光或受热条件下能分解产生二氧化氮、氧气和水,下述三个实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在以下五种离子:Cl﹣、SO42﹣、Fe3+、H+、M,其物质的量浓度之比为c(Cl﹣):c(SO42﹣):c(Fe3+):c(H+):c(M)=5:3:2:3:2,则M可能是( )
A.Ag+
B.Mg2+
C.NO ![]()
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯被称为“黑金”、“新材料之王”,科学家甚至预言石墨烯将成为“彻底改变21世纪”的“黑科技”.石墨的组成元素是( )
A.钙
B.铁
C.硅
D.碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:④_______;________。
(2)画出原子的结构示意图:⑤_________;________。
(3)在①~元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________ (均填元素符号)。
(4)元素⑦与元素⑧相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___(填序号)。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
选项 | 酸性氧化物 | 一元酸 | 电解质 | 分散系 |
A | CO2 | 盐酸 | 氯化钠 | 黄河水 |
B | NO2 | 硫酸 | 盐酸 | 有色玻璃 |
C | SiO2 | 碳酸 | 氢氧化铝 | 云、雾 |
D | SO2 | 硝酸 | 蔗糖 | 冰水混合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.96g四氧化三铁完全溶解在200mL 1mol/L的硫酸中,然后加入K2Cr2O7溶液25 mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
A. 0.05mol/L B. 0.1 mol/L C. 0.2 mol/L D. 0.3 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com