
求:(1)原混合物中各物质的质量各多少克?
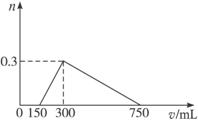
(2)画出向混合液中加入硫酸时,消耗硫酸的体积V(mL)与产生沉淀的物质的量n(mol)的关系图。
(1)m(Al)=5.4 g m(Al2O3)=5.1 g m(Na2O2)=23.4 g
(2)
解析:(1)混合物为Al、Al2O3、Na2O2,它们在水中发生的反应分别为:
2Na2O2+2H2O====4NaOH+O2↑,Al2O3+2NaOH====H2O+2NaAlO2,2Al+2NaOH+2H2O====2NaAlO2+3H2↑
密闭容器中进行的反应为:2H2+O2====2H2O,加入硫酸后又发生了反应2NaOH+H2SO4====Na2SO4+2H2O,2NaAlO2+H2SO4+2H2O====2Al(OH)3↓+Na2SO4,2Al(OH)3+3H2SO4====Al2(SO4)3+3H2O。可见,最后所得溶液中的溶质是Na2SO4、Al2(SO4)3。
设原混合物中含n(Al)=x,n(Al2O3)=y,n(Na2O2)=z,则综合考虑上述七个化学方程式和题给数据可建立以下方程式:27 g·mol-1×x+102 g·mol-1×y+78 g·mol-1×z=33.9 g(①式),1.5x=z(②式)1×0.750 mol·L-1=z+3(x+2y)/2(③式),联立①②③式并解之,x=0.2 mol,y=0.05 mol,z=0.3 mol。进而可知:m(Al)=5.4 g,m(Al2O3)=5.1 g,m(Na2O2)=23.4 g。


科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| H | + 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com