

分析 软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%,软锰矿、闪锌矿与硫酸溶液共热时可析出硫,滤液A为硫酸铁、硫酸锰、硫酸铝、硫酸铜、硫酸镉的水溶液,加入适量金属锌,锌和铁离子反应生成锌离子和亚铁离子,锌和铜离子反应生成铜和锌离子,滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+,过滤得到滤渣为铜、镉,滤液B中加入二氧化锰氧化亚铁离子为铁离子,加入化合物C后可得纯净的ZnSO4、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn(OH)2、MnCO3或ZnCO3,电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸,
(1)MnO2和FeS在酸溶液中发生氧化还原反应生成硫单质、硫酸锰、硫酸铁和水,结合电荷守恒和原子守恒配平书写离子方程式;
(2)代替二氧化锰氧化亚铁离子不能引入难易除去的杂质;
(3)加入化合物C后可得纯净的ZnSO4,MnSO4溶液,C可以是锌锰的氧化物、氢氧化物、碳酸盐,目的是调节溶液PH除去铁离子,得到溶液,通过电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸;
(4)电解过程中MnO2应在阳极生成,因Mn元素失去电子;
(5)①将制得的MnO2(s)与KOH(s),KClO3(s)按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物,结合氧化还原反应电子守恒和原子守恒配平书写化学方程式得到物质的量之比;
②向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣含MnO2(s)将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体 生成产物为二氧化锰、高锰酸钾和碳酸钾;
③二氧化碳过量会生成溶解度小的碳酸氢钾随高锰酸钾晶体析出混入杂质.
解答 解:软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%,软锰矿、闪锌矿与硫酸溶液共热时可析出硫,滤液A为硫酸铁、硫酸锰、硫酸铝、硫酸铜、硫酸镉的水溶液,加入适量金属锌,锌和铁离子反应生成锌离子和亚铁离子,锌和铜离子反应生成铜和锌离子,滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+,过滤得到滤渣为铜、镉,滤液B中加入二氧化锰氧化亚铁离子为铁离子,加入化合物C后可得纯净的ZnSO4、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸,
(1)MnO2和FeS在酸溶液中发生氧化还原反应生成硫单质、硫酸锰、硫酸铁和水,结合电荷守恒和原子守恒配平书写离子方程式为:3MnO2+2FeS+12H+$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3++3Mn2++2S+6H2O,
故答案为:3MnO2+2FeS+12H+$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3++3Mn2++2S+6H2O;
(2)代替二氧化锰氧化亚铁离子不能引入难易除去的杂质,
A.KMnO4固体会氧化亚铁离子,但会引入钾离子,故A不符合;
B.H2O2 可以氧化亚铁离子,且不引入新的杂质,故B符合;
C.浓硝酸会氧化亚铁离子,但会引入硝酸根离子,故C不符合;
D.浓硫酸具有强氧化性,不因人员新的杂质,故D符合
E.新制氯水可以氧化亚铁离子,但会引入氯离子,故D不符合;
故答案为:BD;
(3)加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2,MnCO3或ZnCO3,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:MnCO3或ZnCO3;H2SO4;
(4)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(5)①将制得的MnO2(s)与KOH(s),KClO3(s)按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物,锰元素化合价+4价变化为+6价,电子转移2e-,
氯元素化合价+5价变化为-1价,电子转移6e-,电子转移总数为6e-,配平的化学方程式为:3MnO2(s)+6KOH(s)+KClO3(s)=KCl+3K2MnO4+3H2O,为了使MnO2,KOH,KC1O3恰好完全反应,三者的物质的量之比应为3:6:1,
故答案为:3:6:1;
②向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣含MnO2(s)将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体 生成产物为二氧化锰、高锰酸钾和碳酸钾,反应的化学方程式为:2CO2+3K2MnO4$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+MnO2↓+2K2CO3,
故答案为:2CO2+3K2MnO4$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+MnO2↓+2K2CO3;
③二氧化碳过量会生成溶解度小的碳酸氢钾随高锰酸钾晶体析出混入杂质,③Ⅲ中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出,
故答案为:通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出.
点评 本题考了物质分离提纯的实验过程分析,主要是离子性质、离子分离、离子检验、电解池原理和电极反应书写,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 20.0g | B. | 19.2g | C. | 40.0g | D. | 80.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
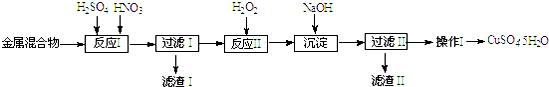
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
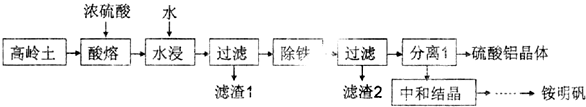
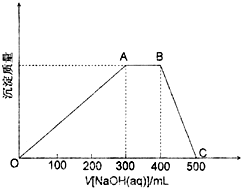
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
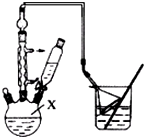 对叔丁基苯酚(
对叔丁基苯酚(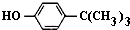 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com