
| 3 |
| 4 |
| A、a=1,b=1 |
| B、a=2,b=1 |
| C、a=2,b=2 |
| D、a=3,b=4 |
| 3 |
| 4 |
| 4 |
| 3 |
| 1+a |
| 0.5+0.5a+0.5b |
| 4 |
| 3 |


科目:高中化学 来源: 题型:
A、以食盐为原料制Na2CO3:2NaCl+2H2O
| |||||||
B、以铜和硫酸为原料制取硫酸铜:2Cu+O2
| |||||||
| C、从海水中提取MgCl2:MgCl2+2NaOH=Mg(OH)2↓+2NaCl Mg(OH)2+2HCl=MgCl2+H2O | |||||||
D、黄铁矿为原料制硫酸:4FeS+7O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 试管内试剂 | 管口湿润的试纸 | 实验现象 | 实验结论 |
| A | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | Cu,稀硝酸 | KI-淀粉试纸 | 变蓝 | NO具有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇 | B、氯仿 |
| C、乙醛 | D、乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
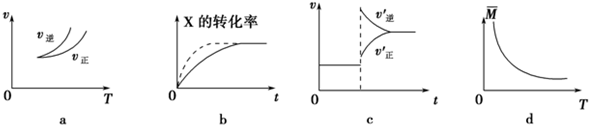
| A、依据图a可判断正反应为吸热反应 |
| B、在图b中,虚线可表示压强增大 |
| C、若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D、由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
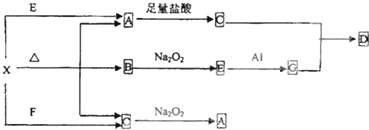
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、③④⑤ |
| C、②④⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com