
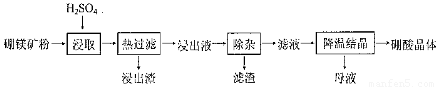
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、 Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、 40. 2 g。Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: ??????????????????????????????????????????????????????????????????????????????????? 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
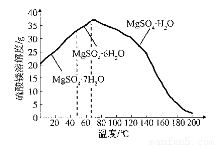
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
计算25℃时0.7mol·L-1 硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
化学式 | 碳酸 | 醋酸 |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是??????????????? 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
(1)分批慢慢加入稀硫酸 (2分)
(2)Fe3+、Fe2+、Al3+(2分,全对才得分)?? 2 Fe2+ +2H+ +H2O2 = 2Fe3+ +2H2O(2分)
(3)防止因温度下降时H3BO3从溶液中析出(2分)
(4)加压升温结晶(2分)
(5)???????????????????? H3BO3 (aq)+H2O (l) [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)
起始时各物质浓度/ mol·L-1: 0.70??????????????????? 0??????????? 0
平衡时各物质浓度/ mol·L-1: 0.70-x????????? ?????????? x??????????? x
K=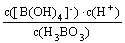 =
= =
=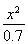 =5.7×10-10
=5.7×10-10
x2=3.99×10-10??? x=2×10-5(mol·L-1)?
(共4分。两段式1分;K的表达式1分;代入数字的式子1分;结果1分)
(6)BD(2分)
【解析】
试题分析:(1)浸取矿粉时,矿分中含有石灰石,所以如果一次性加入硫酸,会导致CaCO3分解产生大量气泡,所以防止大量气泡产生,可以控制加入硫酸的量来控制反应,所以可以分批慢慢加入硫酸。
(2)含有的Fe2+、Fe3+、Al3+等杂质离子在pH分别为3. 2、 5.2、9.7时沉淀,而Mg2+ 在12.4沉淀,所以要用Mg0调节pH使杂质离子沉淀,应该先把Fe2+ 氧化为Fe3+ 而沉淀除去,而最终能够沉淀的离子只有Fe2+、Fe3+、Al3+ ,双氧水的作用为把Fe2+ 氧化为Fe3+ ,反应方程式为2 Fe2+ +2H+ +H2O2 = 2Fe3+ +2H2O。
(3)由于H3BO3在水中的溶解度随温度增大而增大,所以要浸取得到更多的产品,应加热浸出液,并采用热过滤的方法过滤,防止因温度降低H3BO3在水中析出。
(4)从图像可以看出,硫酸镁随着温度不同容易形成不同的晶体,而要收集
到的MgS04·H20在较高温度下才结晶,且该晶体的溶解度随温度升高而减小,所以
要在接近200℃的较高温度下得到该晶体,常压下蒸发结晶较难,应该选择加压升温结晶的方法。
(5)???????????????????? H3BO3 (aq)+H2O (l) [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)
起始时各物质浓度/ mol·L-1: 0.70??????????????????? 0??????????? 0
平衡时各物质浓度/ mol·L-1: 0.70-x????????? ?????????? x??????????? x
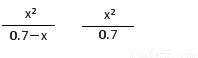 K=
K=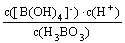 =???????? =???????? =5.7×10-10
=???????? =???????? =5.7×10-10
x2=3.99×10-10??? x=2×10-5(mol·L-1)?
(6)对比硼酸和表格中碳酸、醋酸的电离程度,可知3者的酸性大小为:醋酸>碳酸>硼酸>HCO3-,所以根据酸性大小分析:根据强酸制弱酸原理,碳酸钠溶液滴入硼酸中不能有气泡产生,A错误;碳酸钠溶液滴入醋酸中能观察到有气泡产生 ,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
考点:本题考查的是化学工艺流程题,涉及离子的沉淀、晶体的制备、电离平衡常数的计算和应用等知识。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
 (2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
(2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.

查看答案和解析>>
科目:高中化学 来源: 题型:
 尿素(
尿素(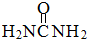 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:查看答案和解析>>
科目:高中化学 来源:2014届东北三省四市教研协作体高三联合考试理综化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道
C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①H3BO3中B的原子杂化类型为 ;
②写出硼酸在水溶液中的电离方程式 。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为 ;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为 。
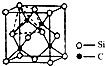
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得右图所示的金刚砂(SiC)结构;若在晶体硅所有Si—Si键中插入O原子即得SiO2晶体。

①在SiC中,每个C原子周围最近的C原子数目为 ;
②判断a. SiO2,b.干冰,c.冰3种晶体的熔点从小到大的顺序是 (填序号)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)镓的基态原子的电子排布式是___ 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)H2Se的酸性比H2S____(填“强”或“弱”)。气态SeO3分子的立体构型为____ 。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—而体现一元弱酸的性质,则[B(OH)4]—中B的原子杂化类型为 。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____,反应的离子方程式为 。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶脆中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(已知lpm=10-12m,只要求列算式,不必计算出数值,阿伏加塞罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com