
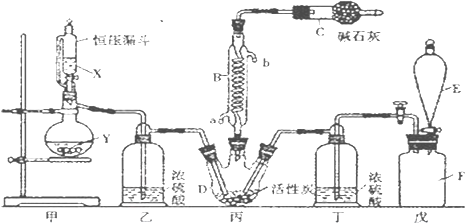
���� �ɣ�3������������װ�ã���֪��װ���Ʊ����������������������ڱ��з�Ӧ����SO2Cl2�����л���̿������������ã�SO2Cl2��ˮ�������ҵ�ˮ�ⷴӦ����Ϊ�����������E��ʢ����Һ���������ų�װ���������������DZ���ʳ��ˮ�����������ܽ�ȣ�������������SO2Cl2�е�͡��ӷ���BΪ�����ܣ�ʹ�ӷ��IJ���SO2Cl2������������ʯ������Ϊ��Ӧ�Ķ���������������ֹ��Ⱦ�����������տ����е�ˮ��������ֹ����C�е��»�����ˮ�⣮
��1������װ��ͼ��֪��EΪ��Һ©���������������ܵ�������������������Ӧ��û�м��ȣ��ݴ��ж�SO2��������ķ�Ӧ����ЧӦ���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ʹƽ�������ƶ���
��2�������Ʊ�SO2��װ�ã�ͭ��Ũ���ᷴӦ��Ҫ���ȣ�����������SO2���ݴ˴��⣻
��3������ˮ�����ڱ���ʳ��ˮ����E�е��Լ��DZ���ʳ��ˮ��������ˮ���ڵ������¿ɽ�SO2���������ᣬ��������ԭΪHCl��
��4������SO2Cl2��H2SO4��BaSO4���㣻
��5��SO2Cl2���ú�ֽ�������������������ܽ��������£�
��� �⣺��1������װ��ͼ��֪��EΪ��Һ©���������������ܵ�������������������Ӧ��û�м��ȣ���SO2��������ķ�ӦΪ���ȷ�Ӧ������ˮ�½��ϳ���a�ڽ��룬�÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ʹƽ�������ƶ��������ڶ��Ȼ��������ɣ��ʴ�Ϊ����Һ©�����ţ�a���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶���ʹƽ�������ƶ��������ڶ��Ȼ��������ɣ�
��2�������Ʊ�SO2��װ�ã�ͭ��Ũ���ᷴӦ��Ҫ���ȣ�����������SO2���ݴ˴��⣬�ʴ�Ϊ��c��
��3������ˮ�����ڱ���ʳ��ˮ����E�е��Լ��DZ���ʳ��ˮ��������ˮ���ڵ������¿ɽ�SO2���������ᣬ��������ԭΪHCl����Ӧ�ķ���ʽΪSO2+Cl2+2H2O=H2SO4+2HCl��
�ʴ�Ϊ������ʳ��ˮ��SO2+Cl2+2H2O=H2SO4+2HCl��
��4������������ж��Ȼ����������ٷֺ���Ϊx����
SO2Cl2��H2SO4��BaSO4
135 233
1.00g��x 1.5g
����135��233=1.00g��x��1.5g
���x=86.9%
�ʴ�Ϊ��86.9��
��5��SO2Cl2���ú�ֽ�������������������ܽ��������£��ʴ�Ϊ����ΪSO2Cl2�����ֽ�����Cl2��Cl2����ʹҺ��ʻ�ɫ��
���� ���⿼��ʵ���Ʊ��������漰�Է�Ӧԭ����װ�ü������ķ������ۡ���������ʶ�����ʵķ����ᴿ�ȣ�ע�������������Ϣ��Ӧ�ã��Ѷ��еȣ�


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeCl3 | B�� | Cu��NO3��2 | C�� | Na2SO3 | D�� | NaAlO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+����c��HCO3-����c��H+����c��OH-�� | B�� | c��Na+��=c��HCO3-��+c��CO32-��+2c��H2CO3�� | ||
| C�� | c��H+��+c��H2CO3��=c��OH-�� | D�� | c��Na+��+c��H+��=c��HCO3-��+c��OH-��+2c��CO32-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3•H2O+HCl�TNH4Cl+H2O | B�� | Ba��OH��2+H2SO4�TBaSO4��+2H2O | ||
| C�� | Al��OH��3+3HCl�TAlCl3+3H2O | D�� | KOH+HNO3�TKNO3+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | e=$\frac{1}{11.2}$mol•L-1����=$\frac{36.5}{224��}$% | B�� | e=$\frac{1}{22.4}$mol•L-1����=$\frac{36.5}{224��}$% | ||
| C�� | e=$\frac{1}{22.4}$mol•L-1����=$\frac{36.5}{112��}$% | D�� | e=$\frac{1}{11.2}$mol•L-1����=$\frac{23}{224}$% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Ag��NH3��2+ | B�� | NH4+ | C�� | OH- | D�� | O22- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
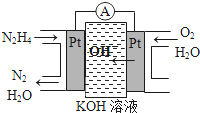 ij������Ԫ�ص�ԭ������������Ϊ������2�����䵥�ʼɷ������·�Ӧ��
ij������Ԫ�ص�ԭ������������Ϊ������2�����䵥�ʼɷ������·�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ����ҺpH | B�� |  ϡ��Ũ���� | C�� |  ����Cl2 | D�� |  ������������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com