
| A. | 都能够在空气中燃烧 | B. | 都能够与水反应 | ||
| C. | 都是柔软的银白色金属(铯略带金色) | D. | 都可以保存在煤油中 |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、棉花和人造丝的主要成分都是纤维素 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物,能发生水解反应 | |
| C. | “地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
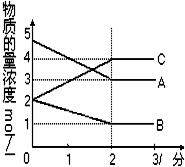 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
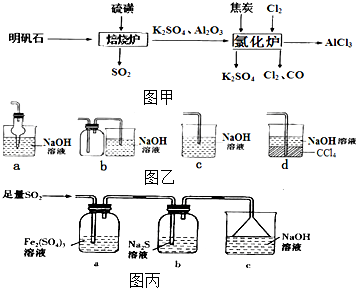 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:
无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•A12(SO4)3•2A12O3•6H2O]制备无水氯化铝的流程如图甲:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com