
| A.D2O与H2O是同位素 | B.SiH4的稳定性>CH4的稳定性 |
| C.氢氟酸的酸性>盐酸的酸性 | D.NaH是离子化合物,其电子式为Na+[ xH] |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.Al元素的第一电离能比Mg元素的大 |
| B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 |
| C.同周期从左到右,原子半径和离子半径均逐渐减小 |
| D.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 σ键”或“p-pσ键”)。键角为 , AD4的等电子体有 。
σ键”或“p-pσ键”)。键角为 , AD4的等电子体有 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
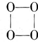 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )| A.O4与O3、O2互为同素异形体 |
| B.O4与H2反应生成冰 |
| C.O4中各原子最外电子层均达到8电子结构 |
| D.O4的化学性质一定比O2稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Z+W
Z+W
 混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气组成为:N2与O2,体积比4:1)
混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气组成为:N2与O2,体积比4:1)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com