
| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
分析 A.加水稀释促进弱电解质的电离,并使得电离方程式中各粒子的浓度减小;
B.加入少量NaOH固体降低了c(H+),平衡向正反应方向移动;
C.加入少量0.1mol•L-1 HCl溶液,增大了c(H+),电离平衡逆向移动;
D.加入少量CH3COONa固体,增大了c(CH3COO-),电离平衡逆向移动.
解答 解:A.加入水时,醋酸的电离平衡正向移动,c(H+)减小,故A错误;
B.加入少量NaOH固体中和了H+,降低了c(H+),平衡向正反应方向移动,故B正确;
C.醋酸部分电离,0.1mol•L-1CH3COOH溶液中c(H+)小于0.1mol•L-1,加入少量0.1mol•L-1 HCl溶液,增大了c(H+),电离平衡逆向移动,故C错误;
D.加入少量CH3COONa固体,增大了溶液中c(CH3COO-),电离平衡逆向移动,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡,难度不大,搞清楚条件是如何改变的,进而准确判断出电离平衡移动的方向是解题的关键,注意条件的改变大于平衡移动的改变.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
 常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:
常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示: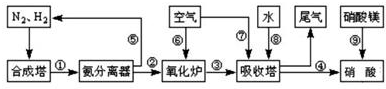
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
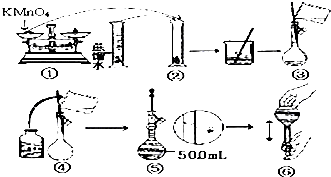 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y22?XY2 | D. | 2X2+Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
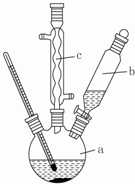 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: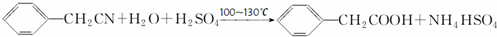 ;
;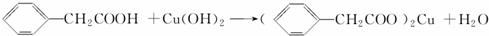
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com