
关于活化分子说法错误的是()
A. 发生有效碰撞的分子一定是活化分子
B. 活化分子间的碰撞一定是有效碰撞
C. 能发生有效碰撞的分子必须具有相当高的能量
D. 使用催化剂能改变分子的活化能
考点: 反应热和焓变.
专题: 化学反应中的能量变化.
分析: A、只有活化分子间有合适的取向、发生的碰撞才能发生化学反应;
B、只有活化分子间有合适的取向、发生的碰撞才是有效碰撞;
C、普通分子间的不能发生有效碰撞;
D、催化剂能降低活化能.
解答: 解:A、物质发生化学反应,必须分子间发生有效碰撞,普通分子间的不能发生有效碰撞,即发生有效碰撞的分子一定是活化分子,故A正确;
B、只有活化分子间有合适的取向、发生的碰撞才能发生化学反应,才是有效碰撞,故B错误;
C、普通分子间的不能发生有效碰撞,能发生有效碰撞的分子必须具有相当高的能量,即活化分子,故C正确;
D、催化剂能降低活化能,所以使用催化剂能改变分子的活化能,故D正确.
故选B.
点评: 本题主要考查了有效碰撞、化学反应的历程等知识,题目难度不大,注意把握活化分子、有效碰撞等概念.


科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i. Cr(OH)4- + FeO42 -+  = Fe(OH)3 (H2O)3↓+ CrO42 -+
= Fe(OH)3 (H2O)3↓+ CrO42 -+
ii.2CrO42 -+2H+=Cr2O72 -+H2O;
iii.Cr2O72 -+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
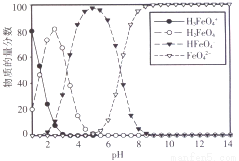
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+ 的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中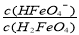 = 。
= 。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家公布了新合成的一种烯烃,始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )

|
| A. | 始祖鸟烯与乙烯互为同系物 |
|
| B. | 若R1=R2=CH3,则其化学式为C12H16 |
|
| C. | 若R1=R2,在一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有11种 |
|
| D. | 始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是( )
|
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注.该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景.已知4.4g CO2气体与H2经催化加成生成CH3OH气体和水蒸气时放出4.95kJ的能量.
(1)该反应的热化学方程式为:
(2)在270℃、8MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48m3(已折合为标准状况)的CO2能合成CH3OH气体的物质的量是 ,此过程中能 放出热量 kJ.
(3)又已知H2O(g)═H2O(l)△H=﹣44kJ/mol,则22g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为 .
(4)根据该反应特点,有利于甲醇合成的条件是 .
A.高压高温 B.低压高温
C.高压低温 D.低压低温.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能源与能量的说法正确的是()
A. 煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B. 蒸汽属于一次能源
C. 凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D. 反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的()
A. 碳酸钠(固体) B. 石灰水 C. 硫酸钾溶液 D. 硫酸铵(固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.硅酸钠溶液中通入CO2气体:SiO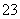 +H2O+CO2===H2SiO3↓+CO
+H2O+CO2===H2SiO3↓+CO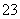
B.硫酸铝与氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH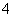
C.氯气与氢氧化钾溶液反应:Cl2+OH-===Cl-+ClO-+2H2O
D.小苏打溶液与稀盐酸反应:HCO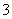 +H+===H2O+CO2↑
+H+===H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:1 时,实际参加反应的FeS 与HNO3的物质的量之比为()
A. 1:6 B. 1:7 C. 2:11 D. 16:25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com