
【题目】
(1)下列关于实验的叙述中正确的有__________。
A.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
B.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
C.使用分液漏斗前要检查其是否漏水 |
D.用托盘天平称量物质质量时,物品应置于右盘 |
E.可燃性气体点燃前一定要验纯
F.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
(2)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);
分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置__________,该分离方法的名称为______________。
②从碘水中分离出I2,选择装置__________,该分离方法的名称为__________,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在 (填“上层”或“下层”)液体中,该层溶液颜色为__________。
③装置A中①的名称是__________,进水的方向是从___________(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作 。
【答案】(1)BCE
(2)①D;A;蒸馏;②B;萃取;下层;紫色(或紫红色)
③冷凝管;下;打开分液漏斗上端活塞或使凹槽对准小孔。
【解析】试题分析:(1)A.实验剩余的药品,既不能放回原瓶,也不可随意丢弃,更不能带出实验室,应放入的指定的容器内,故A错误;B、移走可燃物、隔绝氧气或降低温度到着火点以下都能灭火,湿布扑盖既可以降低温度到着火点以下又可隔绝空气,故B正确;C.分液漏斗能用来盛放液体,且有活塞,使用时必须检查是否漏水,故C正确;D、用托盘天平称量物品质量时,物品应置于左盘,故D错误;E.不纯的可燃性气体燃烧时可能产生爆炸,所以点燃可燃性气体前一定要对气体进行验纯试验,故E正确;F、稀酸不慎沾在衣服或皮肤上,应先用抹布擦去,然后用水冲洗,浓NaOH具有强腐蚀性,所以不能用浓NaOH清洗,故F错误;故答案为:BCE;
(2)①从氯化钾溶液中得到氯化钾固体,应该选用蒸发的方法。选择装置D;分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,可以通过沸点的不同,通过蒸馏分离,选择装置A,故答案为:D;A;蒸馏;
②从碘水中分离出I2,应该选用萃取的方法,选择装置B,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,四氯化碳的密度大于水,在下层,该层溶液呈紫色,故答案为:B;萃取;下层;紫色(或紫红色);
③装置A中①是冷凝管,进水的方向遵循下进上出。分液时为使液体顺利下滴,应该打开分液漏斗上端活塞或使凹槽对准小孔,故答案为:冷凝管;下;打开分液漏斗上端活塞或使凹槽对准小孔。


科目:高中化学 来源: 题型:
【题目】鉴别下列各组物质,只能采用焰色反应的是( )
A.K2CO3 和NaCl
B.KCl和NaNO3
C.NaCl 和MgCl2
D.NaCl 和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是
A. 在含大量Fe3+ 的溶液中:NH4+、Na+、Cl-、SCN-
B. Na2S溶液中: SO42-、 K+、Cl-、Cu2+
C. 0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl-
D. 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制一种仅含四种离子(不考虑水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol/L能达到此目的的是
A. ClO-、I-、K+、Na+ B. Na+、Mg2+ 、SO42-、Cl-
C. Al3+ 、K+、SO42-、NO3- D. Ba2+ 、OH-、CO32-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产生活中有着广泛的应用,下列对应关系错误的是
选项 | 性质 | 实际应用 |
A | 蛋白质受热变性 | 用高温加热的方法杀死流感病毒 |
B | 明矾溶液显酸性 | 用明矾溶液清除铜镜表面的铜锈 |
C | Na2CO3溶液显碱性 | 用热的纯碱溶液洗去油污 |
D | P2O5具有吸水性 | 用P2O5干燥氨气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
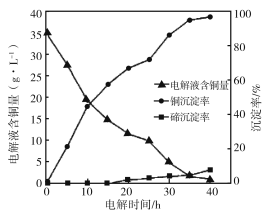
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1 mol/L H2SO4溶液的叙述错误的是( )
A.1 L该溶液中含有H2SO4的质量为9.8 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.2 mol/L
C.从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.01 mol/L
D.取该溶液10 mL,加水稀释至100 mL后H2SO4的物质的量浓度为0.01 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
A.金属铝均剩余
B.金属铝均溶解
C.盐酸中铝剩余,而氢氧化钠中铝全部溶解
D.氢氧化钠这铝剩余,而盐酸中铝全部溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com