
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
以溴乙烷为原料制取乙二醇,需要经过的反应为
A.加成 ― 消去 ― 取代 B.消去 ― 加成 ― 取代
C.消去 ― 取代 ― 加成 D.取代 ― 消去 ― 加成
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=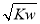 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
下图表示反应X(g)+4Y(g)  5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
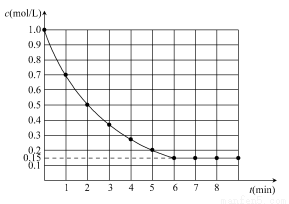
下列有关该反应的描述正确的是( )
A.若Z是有色气体,只压缩容器的体积,平衡不移动,则气体颜色不变
B.若升高温度,则X的平衡转化率减小,v(逆)增大,v(正)减小
C.若X和Y的平衡转化率相等,则起始时X和Y的物质的量之比为1:4
D.若平衡时X的转化率为85%,则起始时Y的物质的量浓度为3.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g)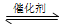 CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是( )
CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是( )
A.在一定条件下,使用催化剂能加快反应速率
B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:填空题
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_____________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
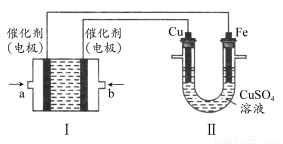
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是________;
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2 Li+2SO2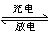 Li2S2O4。下列说法正确的是( )
Li2S2O4。下列说法正确的是( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e-=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:填空题
A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________,D元素的原子结构示意图为_______。
(2)由A、B、C三种元素形成的化合物的电子式为________,这种化合物形成的晶体中所含的化学键类型有________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为__________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子的个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:填空题
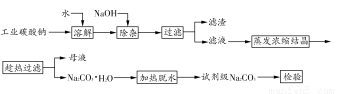
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
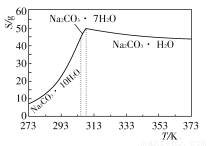
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为____________________________________。
(2)“趁热过滤”的原因是_______________________________________。
(3)若在实验室进行“趁热过滤”,可采用的措施是__________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_______________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com