
| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 用硫和硫铁矿均可做为原料 | |
| B. | SO2转化为SO3,需在催化剂和加热条件下进行 | |
| C. | SO3可用水直接吸收 | |
| D. | 热交换器可对生成气体冷却,对原料气体加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
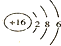
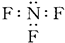
| A. | ②④⑥ | B. | ①④⑥ | C. | ④⑥⑦ | D. | ②④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能与H2O2反应生成H2SO4 | |
| B. | 利用Cl2与石灰乳反应可以制取漂白粉 | |
| C. | Cl2能使紫色石蕊试液先变红后褪色 | |
| D. | 红热的铁丝能在Cl2中剧烈燃烧产生大量的白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 | |
| B. | 工业上用接触法制硫酸,在接触室里制出硫酸 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上主要从海水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化 | |
| C. | 第IA族元素与第VIIA族元素形成的化合物都是离子化合物 | |
| D. | 元素周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦⑧ | B. | ③④⑦⑧ | C. | ②⑤⑧⑨ | D. | ④⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com