
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
分析 A、根据反应Fe3++3SCN-?Fe(SCN)3,增大Fe3+浓度,平衡正向移动;
B、上述b溶液中滴加NaOH溶液,三价铁与氢氧根离子反应生成氢氧化铁沉淀,反应为Fe3++3OH-═Fe(OH)3;
C、实验③中使平衡逆向移动,生成氢氧化铁沉淀,红色变浅,实验④使平衡正向移动,后继续加溶液相当于稀释,红色变浅,原因不同;
D、根据上述分析,实验②、③、④均可说明浓度改变对平衡移动的影响.
解答 解:A、根据反应Fe3++3SCN-?Fe(SCN)3,增大Fe3+浓度,平衡正向移动,故A正确;
B、上述b溶液中滴加NaOH溶液,三价铁与氢氧根离子反应生成氢氧化铁沉淀,反应为Fe3++3OH-═Fe(OH)3↓,故B正确;
C、实验③中使平衡逆向移动,生成氢氧化铁沉淀,红色变浅,实验④使平衡正向移动,后继续加溶液相当于稀释,红色变浅,原因不同,故C错误;
D、根据上述分析,实验②、③、④均可说明浓度改变对平衡移动的影响,故D正确.
故选C.
点评 本题考查了化学平衡移动基本原理,分析浓度对平衡移动的影响,属于基础知识,难度不大,要求学生能根据反应原理判断实验现象.


科目:高中化学 来源: 题型:选择题
| A. | 除②外 | B. | 全部 | C. | ③⑤⑦ | D. | ①③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
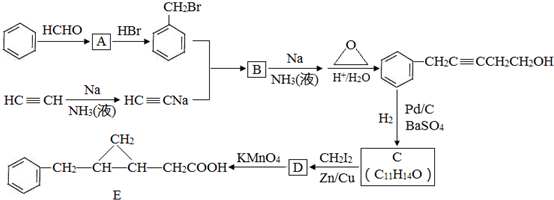
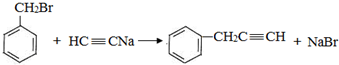 ,反应类型是取代反应.
,反应类型是取代反应.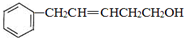 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个.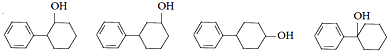 任意2种.
任意2种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
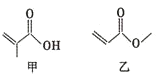
| A. | 甲、乙互为同分异构体 | |
| B. | 一定条件下,甲、乙均能发生取代反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 甲、乙都能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
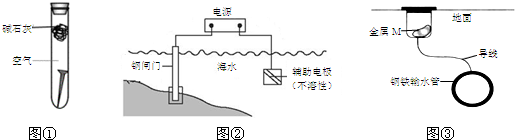
| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
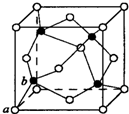 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
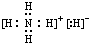 .
.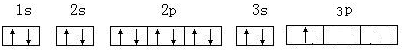 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com