
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1= +1011.0 kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)=2CO(g) ; ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,该反应能自发进行的原因是 ;工业上制备Na
 (3)高温时,用CO还原MgSO4可制备高纯MgO。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是 。
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如右图,则正极的电极反应式为 。
科目:高中化学 来源: 题型:
(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是 ,体积最小的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各式中,属于电离方程式的是
A.HCO3-+ H2O  H2CO3 + OH- B.HCO3- + OH- =H2O + CO32-
H2CO3 + OH- B.HCO3- + OH- =H2O + CO32-
C.NH3 + H+=NH4+ D.N
H3·H2O NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生下列反应: I2(g)+H2(g) 2HI(g) △H> 0。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
2HI(g) △H> 0。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
| 编号 | 反应条件 | 反应速率 |
| ① | 加入催化剂 | |
| ② | 再充入a mol H2 | |
| ③ | 将容器容积扩大为原来2倍 | |
| ④ | 容器容积不变,通入b mol Ne(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一种能使pH试纸变红色的溶液中,下列离子因发生氧化还原反应而不能大量共存的
是
①Ag+、Na+、Al3+、Cl- ②Fe2+、NO3-、Cl-、Na+
③K+、Mg2+、CH3COO-、SO42- ④K+、H+、SO32-、I-
⑤Na+、NO3-、SO42-、I-
A.②⑤ B.①②④ C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组内的溶液相互滴加发生反应时,无论前者滴加到后者中,还是后者滴加到前者中,产生的现象都相同的是
A.碳酸氢钠溶液和澄清石灰水 B.氯化铝溶液和烧碱溶液
C.硫酸铜溶液和氨水 D.二氧化碳水溶液和澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
目前已知化合物中数量、品种最多的是IVA碳的化合物(有机化合物),下列关于其原因的叙述中不正确的是 ( )
A.碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键
B.碳原子性质活泼,可以跟多数元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和三键
D.多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合
查看答案和解析>>
科目:高中化学 来源: 题型:
右图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生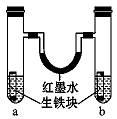 铁块,放置一段时间。下列有关描述错误的是( )
铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试 管中相同的电极反应式是:Fe →Fe2
管中相同的电极反应式是:Fe →Fe2 ++2e-
++2e-
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com