
| A. | 乙酸和乙醇的酯化反应 | |
| B. | 乙醇与Na反应 | |
| C. | 乙醇与氧气在Cu作催化剂条件下反应 | |
| D. | 在镍作催化剂的条件下,苯与氢气反应 |
分析 有机物中的原子或原子团被其它的原子或原子团所取代的反应为取代反应,结合反应中物质结构的变化分析解答.
解答 解:A.乙酸的羧基中-OH被乙醇中CH3CH2O-所取代生成乙酸乙酯,所以乙酸和乙醇中的酯化反应为取代反应,故A正确;
B.乙醇和钠的反应生成的乙醇钠是离子化合物而非共价化合物,所以不是取代反应,故B错误;
C.乙醇和氧气在Cu做催化剂条件下发生氧化反应生成乙醛,所以该反应是氧化反应,故C错误
D.苯和氢气在一定条件下发生加成反应生成环己烷,该反应为加成反应,故D错误;
故选A.
点评 本题以反应类型判断为载体考查有机物结构和性质,为高频考点,明确官能团及其性质关系、反应类型差异性是解本题关键,侧重考查学生分析判断能力,易错选项是B.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
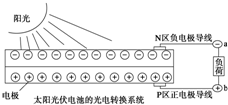
| A. | 光伏发电是将太阳能转变为电能 | |
| B. | Ga与N在元素周期表中不处于同一主族 | |
| C. | YAG中钇显+3价 | |
| D. | 上图中N区半导体为负极,P区半导体为正极,电流从a流向b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
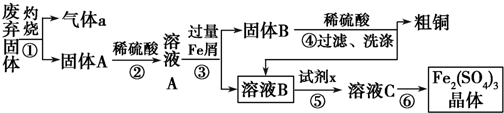
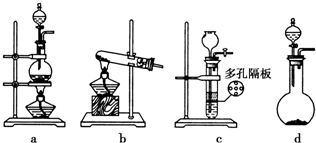
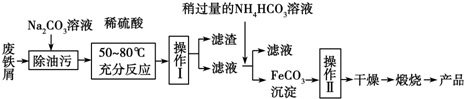
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7
25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | Ca+H2O═Ca(OH)2 | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
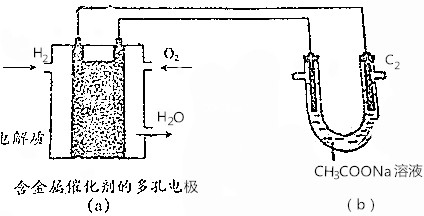
| A. | 若(a)池消耗2.24LH2,则(b)池(C1)极产生0.2mol CO2 | |
| B. | (a)池燃料电池中正极反应式为O2+4e-+4H+═2H2O | |
| C. | 将(b)池电解后的溶液加热蒸干,得到NaOH固体 | |
| D. | (b)池右侧石墨电极(C2)为电解池阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com