
��֪��(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ��H = + 74.9 kJ·mol-1������˵������ȷ���� �� ��
A���÷�Ӧ���ر䡢�ʱ�Դ���0
B���÷�Ӧ�����ȷ�Ӧ�����һ�������Է�����
C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է�����
D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ
 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ��þ���Ͻ�Ͷ�뵽20 mL 1 mol/L��HCl��Һ����Ͻ���ȫ�ܽ������Һ�����1 mol/L��NaO
��һ��þ���Ͻ�Ͷ�뵽20 mL 1 mol/L��HCl��Һ����Ͻ���ȫ�ܽ������Һ�����1 mol/L��NaO H��Һ�����ɳ��������ʵ��������NaOH��Һ���(mL)�仯��
H��Һ�����ɳ��������ʵ��������NaOH��Һ���(mL)�仯�� ��ϵ��ͼ��ʾ������˵������ȷ����(����)
��ϵ��ͼ��ʾ������˵������ȷ����(����)
A��þ���Ͻ���к�ǿ�Ŀ���ʴ�����������ܽ����κ��ᡢ�������
B��cֵԽ�Ͻ���Al�ĺ���Խ��
C��bֵԽ�Ͻ���Mg�ĺ���Խ��
D������c��25��������Ӧ�����У���Ҫ������6�����ӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.1mol��L��CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
A����������NaOH���壬ƽ�����淴Ӧ�����ƶ�
B�������¶ȣ�ƽ��������Ӧ�����ƶ�
C������ˮϡ�ͣ���Һ��c(H+)һ������
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���
( CO2 + 3H2 = CH3OH + H2O )����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء�
��֪ H2(g)�� CO(g) �� CH3OH(l) ��ȼ���ȡ�H�ֱ�Ϊ-285.8 kJ·mol-1��-283.0 kJ·mol-1��-726.5kJ·mol-1����ش��������⣺
(1)��̫���ֽܷ�10molˮ���ĵ�������_____________kJ
(2)���ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ע��T1��T2������300�棩������˵����ȷ����________������ţ�
 ���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
ƽ������Ϊv(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ����
����
(3)��T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ( �� a ��ʾ )
(4)��֪�״�ȼ�յĻ�ѧ����ʽΪ2CH3OH +3O2 =2CO2 +4H2O ����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ �������ķ�Ӧʽ
Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.1mol��L��CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH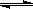 CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
A����������NaOH���壬ƽ�����淴Ӧ�����ƶ�
B�������¶ȣ�ƽ��������Ӧ�����ƶ�
C������ˮϡ�ͣ���Һ��c(H+)һ������
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶�ʱ���͵�BaSO4��Һ�м�ˮ������������ȷ���� �� ��
A��BaSO4�ܽ������Ksp����
B��BaSO4�ܽ�ȡ�Ksp������
C��BaSO4�ܽ�Ȳ��䣬Ksp����
D��BaSO4�ܽ�ȡ�Ksp������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���
( CO2 + 3H2 = CH3OH + H2O )����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء�
��֪ H2(g)�� CO(g) �� CH3OH(l) ��ȼ���ȡ�H�ֱ�Ϊ-285.8 kJ·mol-1��-283.0 kJ·mol-1��-726.5kJ·mol-1����ش��������⣺
(1)��̫���ֽܷ�10molˮ���ĵ�������_____________kJ
(2)���ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ע��T1��T2������300�棩������˵����ȷ����________������ţ�
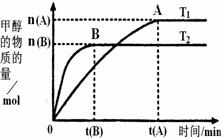 ���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
ƽ������Ϊv(CH3OH)= 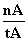 mol·L-1·min-1
mol·L-1·min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ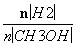 ����
����
(3)��T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ( �� a ��ʾ )
(4)��֪�״�ȼ�յĻ�ѧ����ʽΪ2CH3OH +3O2 =2CO2 +4H2O ����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ �������ķ�Ӧʽ
Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����������Һ�пɷ��������������ӷ�Ӧ��
Ge4����Fe2��===Fe3����Ge3���� Sn2����2Fe3��===2Fe2����Sn4��
�ɴ˿���ȷ��Fe2����Ge3����Sn2���������ӵĻ�ԭ����ǿ������˳���� (�� )
A��Sn2����Fe2����Ge3�� B��Sn2����Ge3����Fe2��
C��Ge3����Fe2����Sn2�� D��Fe2����Sn2����Ge3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ij����̬����ȼ�Ϻ���̼��������Ԫ�ء�Ϊ�˲ⶨ����ȼ����̼����
����Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������������ȼ�գ���ʹ����������ȫ
��ͨ����ͼ��ʾ��װ�ã��õ����±����е�ʵ����(���������������ȫ����
 ��)��
��)��
| ʵ��ǰ | ʵ��� | |
| (�������U�ι�)������ | 101. 1 g | 102. 9 g |
| (ʯ��ˮ�����ƿ)������ | 312. 0 g | 314. 2 g |
����ʵ�����ݣ���
�� ʵ����Ϻ���������ˮ�����ʵ���Ϊ mol��������ƿ������һ�����Σ�������Ϊ g��
�� ��̬����ȼ����̼Ԫ������Ԫ�ص�������Ϊ ��
�� ����̬����ȼ�ϵķ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com