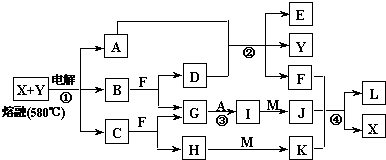
����⣺X�����ڱ��е�ԭ�Ӱ뾶��С��ΪHԪ�أ�Y��Zԭ������������֮��Ϊ10����X��Y��Z��ԭ�������������������Ƴ�D����H��C��O�е�����Ԫ����ɣ���ɫ�ǿ�ȼ�����壩ΪCO
2������֪��X��Y��Z��H��C��O����CΪH
2O��GΪ����ɫ�������壬ӦΪCl
2����C+G��H+I����֪����HCl��HClO��I��Ư�����ã�ӦΪHClO����HΪHCl��dz��ɫ���ػ�ɫ��ҺΪFe
2+��Fe
3+����֪JΪFe��KΪFeCl
2��LΪFeCl
3����Ӧ����������ӡˢ��·��ΪFeCl
3��Cu����MΪCu��BΪCuCl
2��E���������Ƿ�Ӧ��ӦΪCu��OH��
2��FΪCu
2O����A+H��HCl��=B��CuCl
2��+C��H
2O��+D��CO
2����֪��A�Ǻ���Cu
2+��̼���Σ�ӦΪCuCO
3��Cu
2��OH��
2CO
3�����и��ߡ�A�Ǻ�������Ԫ�صĻ��������֪AӦΪCu
2��OH��
2CO
3��
��1�������Ϸ�����֪AΪCu
2��OH��
2CO
3��IΪHClO������ʽΪ
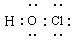
��
�ʴ�Ϊ��Cu
2��OH��
2CO
3��
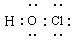
��
��2��YΪCԪ�أ�ZΪOԪ�أ�λ��ͬһ���ڣ�ԭ�Ӱ뾶C��O���ʴ�Ϊ������
��3�������Ǻ�������ͭ��Һ�ڼ��������·�Ӧ�ķ���ʽΪCH
2OH��CHOH��
4CHO+2Cu��OH��
2 CH
2OH��CHOH��
4COOH+Cu
2O��+2H
2O��
�ʴ�Ϊ��CH
2OH��CHOH��
4CHO+2Cu��OH��
2 CH
2OH��CHOH��
4COOH+Cu
2O��+2H
2O��
��4��FΪCu
2O����ϡ���ᷴӦ��������ͭ��NO����Ӧ�����ӷ���ʽΪ3Cu
2O+14H
++2NO
3-=6Cu
2++2NO��+7H
2O���ʴ�Ϊ��3Cu
2O+14H
++2NO
3-=6Cu
2++2NO��+7H
2O��
��5��KΪFeCl
2������NaOH��Һ������Fe
2++2OH
-=Fe��OH��
2�������ɰ�ɫ��������Fe��OH��
2���ȶ����ױ�������������������Fe��OH��
3������4Fe��OH��
2+O
2+2H
2O=4Fe��OH��
3���������ǰ�ɫ������Ȼ����ٱ����ɫ��������ɫ��
�ʴ�Ϊ���Ȳ�����ɫ������Ȼ����ٱ����ɫ��������ɫ��Fe
2++2OH
-=Fe��OH��
2����4Fe��OH��
2+O
2+2H
2O=4Fe��OH��
3����

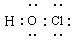 ��
��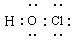 ��
��




 ]2-Na+
]2-Na+ ]2-Na+
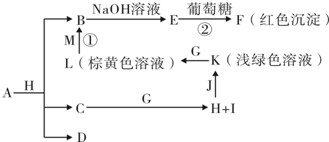
]2-Na+ ��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+