
常温时,下列叙述正确的是
A. pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c )
B. pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C. AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D. 1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
B
【解析】
试题分析:A、pH=9的NH4Cl与NH3·H2O混合溶液中NH3·H2O的电离程度大于NH4Cl的水解程度,所以c(Cl-)<c(NH4+),错误;B、pH=2.5的可乐中c(H+)=1×10-2.5mol/L,pH=3.5的柠檬水中c(H+)=1×10-3.5mol/L,前者是后者的10倍,正确;C、0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的氯离子的浓度不同,影响氯化银的溶解平衡,导致AgCl的溶解度不同,错误;D、Kw是温度常数,温度不变,Kw不变,错误,答案选B。
考点:考查混合液的离子浓度的比较,pH的计算,溶液稀释过程中pH和Kw的判断,同一物质在不同溶剂中的溶解度的判断


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.CHCl=CHCH3不存在顺反异构
B.油脂在酸性、碱性条件下都能水解,水解产物相同
C. 蛋白质溶液中加入饱和Na2SO4溶液,可使蛋白质析出,从而进行分离
D.淀粉溶液与稀硫酸共热,再加新制Cu(OH)2共热,无红色沉淀,证明淀粉没水解
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.布朗运动就是液体分子的热运动
B.对一定质量的气体加热,其内能一定增加.
C.物体的温度越高,分子热运动越剧烈,分子的平均动能越大
D.分子间的引力与斥力同时存在,斥力总是小于引力
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:简答题
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
操 作 | 现 象 |
通入氯气至过量
| I.A中溶液变红 II.稍后,溶液由红色变为黄色
|
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.钙和氮均为人体所需的微量元素
B.二氧化硅是太阳能电池的主要材料
C.油脂和蛋白质均属于高分子化合物
D.明矾与水作用能生成有吸附性的物质
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
现有X、Y两种VA族元素,下列事实不能说明X的非金属性比Y强的是
A.两种元素所形成的气态氢化物的稳定性:XH3>YH3
B.两种元素所形成的酸的酸性:H3XO4>H3YO4
C.两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5
D.两种元素形成气态氢化物的难易程度:X易于Y
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术](15分)
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下:


请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中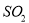 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中,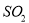 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择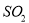 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。

(4)已知:焙烧明矾的化学方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 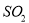 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
A.向装置中通入氮气且保持体积不变
B.向装置中通入氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列说法中错误的是
A.当中心原子的配位数为6时,配合单元常呈八面体空间结构
B.SO3为平面正三角形结构
C.已知[Cu (NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型
D.配位数为4的配合物均为正四面体结构
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)有机物A的相对分子质量为:______. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | (2)9.0g有机物A完全燃烧时,经计算: 生成CO2共为______mol, 生成的H2O______g. 有机物A的分子式______. |
| (3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)A的结构简式______.写出A生成B的化学方程式______. |
| (4)有机物A可自身发生酯化反应生成六原子环的酯B. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com