
 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
分析 测得乙中c电极质量增加了8g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
(2)由分析可知,B为CuSO4,根据电子守恒计算乙中生成的氢离子的物质的量浓度,再求出pH;电解时,氢离子在阳极生成;
解答 解:测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)e电极上氢离子放电生成氢气,n(Cu)=$\frac{8g}{64g/mol}$=0.125mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.125mol×22.4L/mol=2.8L,
故答案为:2.8L;
(2)由分析可知,B为CuSO4,乙中电解方程式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,则Cu~2e-~2H+,所以溶液中的氢离子浓度为$\frac{0.25mol}{0.25L}$=1mol/L,则pH=0;电解时,氢氧根离子在阳极失电子生成氧气,同时生成氢离子,所以阳极附近有氢离子,即d极先变红;
故答案为:CuSO4;0;d.
点评 本题考查电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
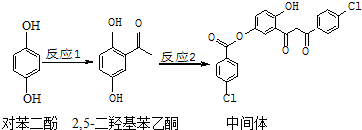
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
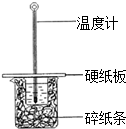 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| B. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| C. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4 $→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$NgCl2(ag) $\stackrel{电解}{→}$Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$FeCl3(ag) $\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | Cu $\stackrel{稀硝酸}{→}$NO2 $\stackrel{水}{→}$NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的原子L层电子数是K层电子数的2倍 |
| Y | Y是短周期元素中原子半径最大的元素(除稀有气体元素外) |
| Z | Z的原子最外层电子数等于电子层数 |
| W | W原子最外层电子数是X、Z原子最外层电子数之和 |
 ,X的气态氢化物电子式为
,X的气态氢化物电子式为 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com