
CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )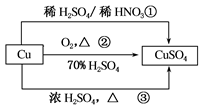
| A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2 |
| B.与途径①、③相比,途径②更好地体现了绿色化学思想 |
| C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③ |
| D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |
D
解析试题分析:A、Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确;B、相对于途径①、③,途径②的优点:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生,故B正确;C.生成等量的硫酸铜,三个途径中①②参加反应的硫酸的物质的量相等,而③生成SO2,消耗更多的硫酸,则①=②<③,故C正确;D.途径②中硫酸只表现为酸性,没有被还原,故D错误,故选D。
考点:考查硫酸铜制备方案的评价


科目:高中化学 来源: 题型:实验题
某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1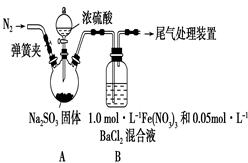
请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想:
猜想一:只显+2价 猜想二:只显+3价;猜想三: 。
(2)为证明猜想二通过完成下表加以验证。供选试剂有: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L H2SO4溶液、3%H2O2溶液、0.1 mol/LKSCN溶液、蒸馏水。(仪器自添)
| 实验操作 | 现象 | 目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 | | 溶解固体产物 |
| 步骤2: | | 溶液中含有Fe3+ |
| 步骤3: | | 溶液中不含 Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.同体产物为MgO。
II.假设为______________。
III.假设为:______________。
请回答下列问题:
资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
(1)如图连接好仪器,装药品前如何检验装置的气密性_______。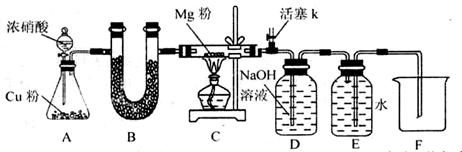
(2)装置B中盛装的干燥剂可以是(填序号)_______。
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的都是______________。
(4)E中收集到的气体对氢气的相对密度是14,该气体是_______。
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设_______成立。C中发生的化学反应方程式为______________
(6)本实验中存在明显缺陷,改进措施是___________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。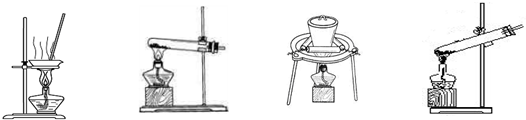
A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论: 。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 | 现象: ; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向1.00L0.3mol·L-NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,有关该溶液
的说法正确的是
| A.溶质为Na2CO3 |
B.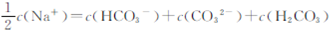 |
C.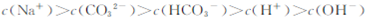 |
D.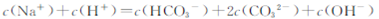 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
| A.硫酸铜溶液 | B.硝酸钠溶液 | C.醋酸钠溶液 | D.氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于浓硝酸和浓硫酸的叙述,正确的是( )
| A.常温下都能用铝制容器贮存 |
| B.常温下都能与铜较快反应 |
| C.露置在空气中,容器内酸液的质量减轻 |
| D.露置在空气中,容器内酸液的浓度均因吸水而降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com