
在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,不可能大量存在的阴离子是
[ ]
科目:高中化学 来源:江西省上高二中2008-2009学年度下学期高二第三次月考化学试卷 题型:013
|
下列各组离子能在指定溶液中,大量共存的是 ① 含有大量AlO2-的溶液:Al3+、SO42-、ClO-、Na+
②使 pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-③由水电离的 H+浓度c(H+)=1×10-13 mol/L的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O32-④加入 Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-⑤使甲基橙变红的溶液中: Fe3+,MnO4-,NO3-,Na+,SO42-⑥酸性溶液中: Fe2+,Al3+,NO3-,I-,S2- | |
| [ ] | |
A. |
①②⑤ |
B. |
①③⑥ |
C. |
②④⑤ |
D. |
①②④ |
查看答案和解析>>
科目:高中化学 来源:山东省鄄城二中2011届高三12月练兵(2)化学试题 题型:013
|
以NA表示阿伏伽德罗常数,下列说法正确的是 | |
| [ ] | |
A. |
1 mol NH4+含有10NA个质子 |
B. |
T℃时1 L pH=6的纯水中,含10-6NA个OH- |
C. |
78 g Na2O2离子化合物中含阴离子的个数是2NA |
D. |
0.01 mol Mg在CO2中燃烧转移电子数为0.01NA |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃白银市平川中恒学校高一下学期期末考试化学试卷(带解析) 题型:填空题
(14分)阅读并完成以下各项内容:
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个化学反应的方程式:________________ , 。
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成 ________和NO。
③酸雨可导致的危害有________(填序号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.恶化人类环境
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮的氧化物用________吸收。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。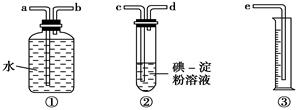
①若原料气从左向右流时,上述装置连接的顺序是:原料气→________ (用字母和箭头表示)。
②装置②中发生反应的离子方程式为: ;
当装置②中出现________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是________。
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期练习化学试卷 题型:实验题
(10分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
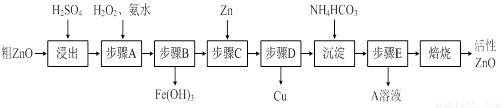
已知:几种离子生成氢氧化物沉淀时的pH如下表:
|
待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
|
开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
|
完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请问答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ▲ ,该步骤需控制溶液pH的范围是 ▲ 。
(2)A溶液中主要含有的溶质是 ▲ 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是:△S ▲ (选填“=”、“>”、“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(10分)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+) =0.056 mol•L-1,那么需调节溶液的pH = ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)=1: 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)
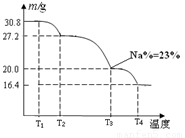
(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。 [来源:ZXXK]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com