
【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
【答案】C
【解析】
A.溶液的体积不等于溶剂的体积;
B.溶液具有均一性,溶液各处的浓度相等;
C.先计算酸的物质的量,再根据反应时二者物质的量关系,计算NaOH的物质的量,利用n=![]() ,计算NaOH的质量;
,计算NaOH的质量;
D.计算溶质CuSO4的物质的量,利用元素守恒,得到胆矾的物质的量,最后根据n=![]() ,计算胆矾的质量。
,计算胆矾的质量。
A. 40.0 g NaOH的物质的量是1mol,将其溶解在1L水中,得到的溶液体积不是1L,所以不能确定溶液的浓度,A错误;
B.溶液的浓度与取出的体积大小无关,所以从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度仍为2mol/L,B错误;
C.100 mL 1mol/L的H2SO4的物质的量是n(H2SO4)=1mol/L×0.1L=0.1mol,根据H2SO4+2NaOH=Na2SO4+2H2O,可知需消耗NaOH的物质的量是n(NaOH)=2 n(H2SO4)=0.2mol,则其质量是m(NaOH)= n×M=0.2mol×40g/mol=8.0g,C正确;
D.配制500mL0.5mol/L的CuSO4溶液,需要溶质的物质的量是n(CuSO4)= 0.5mol/L×0.5L=0.25mol,由于用CuSO45H2O配制,根据Cu元素守恒可知需n(CuSO45H2O)= n(CuSO4)=0.25mol,质量是m(CuSO45H2O)=n×M=0.25mol×250g/mol=62.5g,D错误;
故合理选项是C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式不正确的是( )
A. Al溶于NaOH溶液:2Al + 2H2O + 2NaOH ==2NaAlO2 + 3H2↑
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32- + H2O
C. 热的浓NaOH溶液与NH4Cl液混合产生气体:NH4+ + OH-![]() NH3↑+ H2O
NH3↑+ H2O
D. 实验室用NaOH溶液吸收多余的NO2:3NO2 +2OH—=2NO3—+H2O+NO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为 _____________________;
(4)溶液D中通入过量CO2生成沉淀F的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
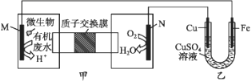
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 1mol/L的Na2CO3溶液中含有钠离子约为2×6.02×1023
B. 含氧原子数均为NA的O2和O3的物质的量之比为3:2
C. 每1mol任何物质均含有约为6.02×1023个原子
D. 含氢原子数目相同的NH3和CH4在同温同压下的体积之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气,②澄清石灰水,③水银,④稀盐酸,⑤氯化铜固体,⑥熔融氢氧化钠,⑦蔗糖,⑧酒精,⑨二氧化碳,⑩硫酸钡。其中属于电解质的是______(填序号,下面相同),属于非电解质的是_________,能导电的是_________。
(2)写出高锰酸钾受热分解制氧气的化学反应方程式____________________,反应中的氧化剂是________,还原产物是____________,当有2mol电子转移时,生成的氧气在标准状况下的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树脂交联程度决定了树脂的成膜性。下面是一种成膜性良好的醇酸型树脂的合成路线,如下图所示。

(1)B的分子式为C4H7Br,且B不存在顺反异构,B的结构简式为________,A到B步骤的反应类型是_________。
(2)E中含氧官能团的名称是_________,D的系统命名为_________。
(3)下列说法正确的是_________。
A.1 mol化合物C最多消耗3 mol NaOH
B.1 mol化合物E与足量银氨溶液反应产生2 mol Ag
C.F不会与Cu(OH)2悬浊液反应
D.丁烷、1-丁醇、化合物D中沸点最高的是丁烷
(4)写出D、F在一定条件下生成醇酸型树脂的化学方程式_________。
(5)  的符合下列条件的同分异构体有_______种。
的符合下列条件的同分异构体有_______种。
①苯的二取代衍生物;②遇FeCl3溶液显紫色;③可发生消去反应
(6)①己知丙二酸二乙酯能发生以下反应:

②C2H5OH+HBr→C2H5Br+H2O
利用上述反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇钠为原料合成 ,请你设计出合理的反应流程图__________________。
,请你设计出合理的反应流程图__________________。
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com